题目内容
常温时,下列说法正确的是
| A.pH=5的NH4Cl溶液中,由水电离出的c(H+)为10-9 mol/L |
| B.pH=3的醋酸和pH=11的NaOH溶液等体积混合后,pH>7 |
| C.在c(H+):c(OH-)=1:1012的溶液中,Na+、I-、NO3-、SO32-能大量共存 |
| D.0.1 mol/L Na2CO3溶液和0.1 mol/L NaHSO4溶液等体积混合,溶液中c(Na+)+c(H+)=c(CO32-)+c(SO42-)+c(HCO3-)+c(OH-) |
C
试题分析:A不正确,氯化铵水解促进水的电离,由水电离出的c(H+)为10-5 mol/L;B中醋酸是弱酸,浓度大于0.001mol/L,因此反应后醋酸过量,溶液显酸性,B不正确;C中根据水的离子积常数可知,OH-离子浓度是0.1mol/L,即溶液显碱性,可以大量共存,C正确;D中恰好生成碳酸氢钠和硫酸钠,根据电荷守恒可知,c(Na+)+c(H+)=2c(CO32-)+2c(SO42-)+c(HCO3-)+c(OH-),D不正确,答案选C。
点评:该题容易错选B。这是由于在判断酸碱中和后的溶液的酸碱性时,只想着生成盐的水解,而忽略了酸碱的过量问题。因此在判断酸碱中和后的溶液的酸碱性时,首先要先判断酸碱的过量问题,只有当酸恰好反应时,才能考虑生成的盐是否水解。

练习册系列答案
相关题目
 H++HA-,HA-
H++HA-,HA-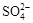 、K+
、K+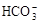 、Na+
、Na+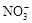 、ClO-、K+
、ClO-、K+