题目内容
下列说法正确的是( )
| A.冰融化时,分子中H—O键发生断裂 |
| B.随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高 |
| C.由于H—O键比H—S键牢固,所以水的熔沸点比H2S高 |
| D.在由分子所构成的物质中,分子间作用力越大,该物质越稳定 |
B
解析

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
X、Y、Z、W是前20号元素,原子序数依次增大。X是原子半径最小的元素;Y元素原子的最外层电子数是电子层数的2倍;Z元素的-1价阴离子的核外电子排布与氖原子相同,W元素为金属,它的某种化合物可用于烟气脱硫。下列说法错误的是
| A.X、Y形成的化合物中可能含有双键 |
| B.X单质和Z单质在暗处能剧烈反应 |
C.W元素与Z元素形成的化合物用电子式表示形成过程为: |
| D.XZ的沸点在与Z同族的其它X的化合物中最高 |
某粒子结构示意图为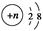 ,若该粒子为离子,则它所带的电荷数可能为( )。
,若该粒子为离子,则它所带的电荷数可能为( )。
①8-n ②n-8 ③10-n ④n-10
| A.①② | B.①③ | C.③④ | D.②④ |
下列有关原子核外电子排布的说法不正确的是 ( )。
| A.电子总是先排布在能量最低的电子层里 |
| B.每个电子层最多能容纳的电子数为2n2 |
| C.最外层电子数不超过8个(K为最外层时不超过2个) |
| D.S2-的M层电子数是K层电子数的3倍 |
已知钡的金属活动性处于钾和钠之间。则下列变化中可能实现的是( )。
| A.钡可从氯化钠溶液中置换出金属钠 |
| B.钡可从冷水中置换出氢气 |
| C.钡可从硫酸铜溶液中置换出铜 |
| D.在溶液中Ba2+可氧化金属锌,生成Zn2+ |
俄罗斯科学家用一种钙原子轰击含95个质子的镅原子,成功合成4个第115号元素的原子,这4个原子生成数微秒后衰变成第113号元素。下列有关叙述正确的是( )。
| A.115号元素在第六周期 |
| B.113号元素在第七周期ⅢA族 |
| C.115号和113号元素都是非金属元素 |
| D.镅元素和115号元素不在同一周期 |
对四种元素G、L、M、R进行如下实验:
| 金属 实验 | G | L | M | R |
| 和冷水反应 | 不反应 | 慢慢反应 | 未做实验 | 未做实验 |
| 和2 mol·L-1 盐酸反应 | 溶解并放 出气体 | 溶解并 放出气体 | 不反应 | 不反应 |
| 和Rn+的 水溶液反应 | 溶解并形 成沉淀 | 未做实验 | 溶解并 形成沉淀 | 未做实验 |
根据表中所给实验结果,判断这四种金属活泼性由强到弱的顺序正确的是( )
A.L、G、R、M B.G、L、M、R
C.L、G、M、R D.L、R、G、M
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )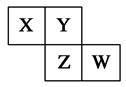
| A.X的气态氢化物比Y的稳定 |
| B.W的最高价氧化物对应水化物的酸性比Z的强 |
| C.Z的非金属性比Y的强 |
| D.X与Y形成的化合物都易溶于水 |
下列判断正确的是( )
| A.第三、四周期同主族元素的原子序数相差8 |
| B.任何原子都是核外电子层数等于该元素在周期表中的周期数 |
| C.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素 |
| D.短周期中族序数与周期数相同的元素是H、Be |