题目内容
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为

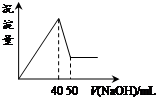

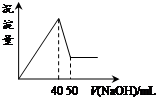
| A.1:3 | B.1:2 | C.1:1 | D.2:1 |
C
试题分析:首先发生反应Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,然后发生反应Al(OH)3+OH-═AlO2-+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的体积为10mL,根据离子方程式Al3++3OH-═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的体积为10mL×3=30mL,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液40mL,计算沉淀Mg2+消耗的氢氧化钠溶液的体积为40mL-30mL=10mL,则n(Mg2+):n(Al3+)=
 ×10mL:
×10mL: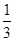 ×30mL=1:2,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为1:1,故选C。
×30mL=1:2,故原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为1:1,故选C。
练习册系列答案
相关题目
 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;






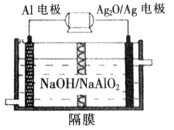
 2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是
2K2SO4+2Al2O3 +9SO2 +48H2O,下列判断正确的是