题目内容
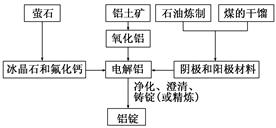
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
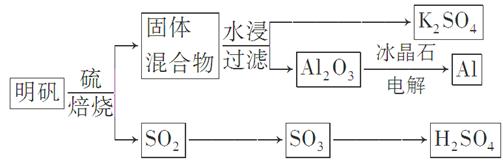 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是________。
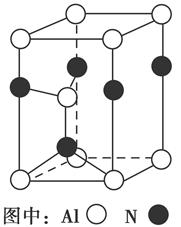
(3)Al2O3在一定条件下可制得AlN,其晶体结构如右图所示,该晶体中Al的配位数是________。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g) 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;
H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是________。焙烧948 t明矾(M=474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
 焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是________。
(2)从水浸后的滤液中得到K2SO4晶体的方法是________。

(3)Al2O3在一定条件下可制得AlN,其晶体结构如右图所示,该晶体中Al的配位数是________。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是________。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197 kJ/mol;
2SO3(g) ΔH1=-197 kJ/mol;H2O(g)=H2O(l) ΔH2=-44 kJ/mol;
2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) ΔH3=-545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是________。焙烧948 t明矾(M=474 g/mol),若SO2的利用率为96%,可生产质量分数为98%的硫酸________t。
(1)S(硫) (2)蒸发结晶 (3)4
(4)Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
(5)SO3(g)+H2O(l)=H2SO4(l) ΔH=-130 kJ/mol 432
(4)Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2
(5)SO3(g)+H2O(l)=H2SO4(l) ΔH=-130 kJ/mol 432
结合流程图,根据物质的溶解性去分析解决问题。(1)根据焙烧明矾的化学方程式中各元素的化合价可知,明矾中部分硫元素的化合价降低,而硫单质在反应中元素的化合价升高,故还原剂为单质硫。(2)从滤液中得到晶体的方法为蒸发结晶。(3)由图中的晶体结构可以看出每个Al原子的周围距离相等且最近的N原子有4个,故其配位数为4。(4)放电时Al作负极,失电子被氧化,NiO(OH)在正极得电子,反应的方程式为Al+3NiO(OH)+NaOH+H2O=NaAlO2+3Ni(OH)2。(5)给题中的三个热化学方程式分别编号为①、②、③,根据盖斯定律由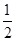 (③-①)-②可得到目标热化学方程式;设可生成硫酸的质量为x吨,据题意列式得到
(③-①)-②可得到目标热化学方程式;设可生成硫酸的质量为x吨,据题意列式得到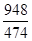 ×
× ×96%=
×96%=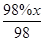 ,故x=432。
,故x=432。
点拨:知识:氧化还原反应、实验基本操作、原子配位数、原电池电池反应方程式、热化学方程式。能力:考查考生框图推断能力、读图识图分析图像能力、知识应用能力。试题难度:较大。
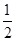 (③-①)-②可得到目标热化学方程式;设可生成硫酸的质量为x吨,据题意列式得到
(③-①)-②可得到目标热化学方程式;设可生成硫酸的质量为x吨,据题意列式得到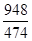 ×
× ×96%=
×96%=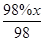 ,故x=432。
,故x=432。点拨:知识:氧化还原反应、实验基本操作、原子配位数、原电池电池反应方程式、热化学方程式。能力:考查考生框图推断能力、读图识图分析图像能力、知识应用能力。试题难度:较大。

练习册系列答案
 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目