题目内容
【题目】乳化炸药中微量水的存在严重影响产品品质,Karl Fischer法是测定其中微量水含量常用方法,该方法是利用I2和SO2反应定量消耗水作为原理,据此回答下列问题:
(1)写出该反应的化学反应方程式:_______________________。
下图是某同学在实验室模拟Karl Fischer法的实验装置图:

(2)实验开始时,向D装置中加入10.00克乳化炸药样品和10.16克I2(已知I2过量),打开所有止水夹,向装置内部通入N2,其目的是_______________________。
(3)关闭止水夹K1,打开分液漏斗活塞,加入硫酸后关闭,充分反应后,A中仍有SO2产生,关闭K2,此时B的作用是_______________________。B在反应过程中还能起到的作用是___________________________。
(4)反应后,将D装置取下,用N2赶走剩余SO2后加适量水配成250.00mL溶液,取25.00mL用0.20mol·L-1Na2S2O3标准液滴定剩余I2单质,已知反应如下:2S2O32-+I2=S4O62-+2I-,多次实验平均与消耗Na2S2O32溶液20.00mL,则原乳化炸药中水的含量为_________(填百分比)。
(5)若在滴定过程中不小心将标准液洒出去几滴,则水含量测定结果将____________(填“偏高”、“ 偏低”或“不变”)。
【答案】 SO2+I2+2H2O=2HI+H2SO4 赶走装置内部的空气,防止空气中O2和水蒸气对实验的影响 临时储气装置 平衡装置内部大气压 7.2% 偏低
【解析】试题分析:(1).I2和SO2、H2O反应生成硫酸和氢碘酸;(2)向装置内部通入N2,可以赶走装置内部的空气;(3)关闭K2,A中生成的二氧化硫储存在B中;B中的长颈漏斗与空气相连,可以起到平衡装置内部大气压的作用;(4)25.00mL溶液消耗Na2S2O3溶液20.00mL,则250.00mL溶液消耗Na2S2O3溶液200.00mL,根据二氧化硫、Na2S2O3共消耗10.16克I2计算水的含量;(5)若在滴定过程中不小心将标准液洒出去几滴,消耗Na2S2O3溶液的体积偏大,与水反应的碘偏少;
解析:(1).I2和SO2、H2O反应生成硫酸和氢碘酸,反应方程式是SO2+I2+2H2O=2HI+H2SO4;(2)向装置内部通入N2,可以赶走装置内部的空气,防止空气中O2和水蒸气对实验的影响;(3)关闭K2,A中生成的二氧化硫储存在B中,所以B的作用是临时储气装置;B中的长颈漏斗与空气相连,可以起到平衡装置内部大气压的作用;(4)根据以上分析,则250.00mL溶液消耗Na2S2O3溶液200.00mL,根据2S2O32-+I2=S4O62-+2I-,Na2S2O3消耗碘单质的物质的量为![]() ,二氧化硫、Na2S2O3共消耗10.16克I2,SO2+I2+2H2O=2HI+H2SO4反应消耗碘单质的物质的量为
,二氧化硫、Na2S2O3共消耗10.16克I2,SO2+I2+2H2O=2HI+H2SO4反应消耗碘单质的物质的量为![]() ,SO2+I2+2H2O=2HI+H2SO4反应消耗水的物质的量是0.04mol,原乳化炸药中水的含量为
,SO2+I2+2H2O=2HI+H2SO4反应消耗水的物质的量是0.04mol,原乳化炸药中水的含量为![]() ;(5)若在滴定过程中不小心将标准液洒出去几滴,消耗Na2S2O3溶液的体积偏大,与水反应的碘偏少,所以水含量测定结果将偏低。
;(5)若在滴定过程中不小心将标准液洒出去几滴,消耗Na2S2O3溶液的体积偏大,与水反应的碘偏少,所以水含量测定结果将偏低。

【题目】金属钛因为其优越的性能被称为“未来金属”,其工业冶炼涉及到的反应如下:TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
回答下列相关问题:
(1)钛的价层电子排布式为______________。
(2)已知部分物质熔沸点如下:
名称 | 金红石 | 金刚石 | 四氯化钛 | 四溴化钛 | 四碘化钛 |
化学式 | TiO2 | C | TiCl4 | TiBr4 | TiI4 |
熔点 | 1830℃ | 3550℃ | -24.1℃ | 38℃ | 150℃ |
沸点 | 2927℃ | 4827℃ | 136.4℃ | 233.1℃ | 377.2℃ |
晶型 | 离子晶体 | 分子晶体 | |||
表中金刚石的晶型为_________;自左向右,表中的三种钛的卤化物熔沸点依次升高的原因是_____________。
(3)配位数为6,组成为TiCl3·6H2O的晶体有两种:化学式为[TiCl(H2O)5]Cl2·H2O的X呈绿色,定量实验表明,X与AgNO3以1:2物质的量比反应生成沉淀。Y呈紫色,且Y与AgNO3以1:3物质的量比反应生成沉淀,则Y的化学式为___________,Y配离子的空间构型为_________。
(4)钙钛矿是重要的含钛矿物之一,其主要成分Z的晶胞如下图所示:
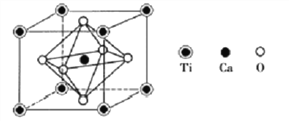
推测Z的化学式为________________。
(5)若晶胞参数a=384.1pm,Z晶体的密度为______g/cm3(已知NA≈6.0×1023;3.8413≈![]() )。
)。






