题目内容
 A、B、C、D、E为五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的
A、B、C、D、E为五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的| 3 | 4 |
请回答下列问题:
(1)写出下列元素的元素符号:B
(2)C与E形成化合物时化学键的类型是
(3)D与C的氧化物水化物在溶液中反应的离子方程式为
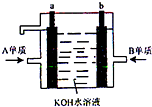
(4)用A元素的单质和B元素的单质制成的新型化学电源已在宇宙飞船中使用.如图所示,两个电极均由多孔性材料制成,气体由空隙中通入,并在电极表面放电.
①a是
②b极的电极反应式为:
分析:A、B、C、D、E为五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,B元素原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,则B最外层6,次外层为2,B为O元素;
C与A同主族,且与E同周期,E元素的最外层电子数是次外层电子数的
倍,次外层为8个电子,最外层为6个电子,第一电子层为2个电子,且属于短周期元素,所以E是S元素,
D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成,则D是Al元素,A为H元素,C为Na元素,根据元素、单质和化合物的性质来分析解答.
C与A同主族,且与E同周期,E元素的最外层电子数是次外层电子数的
| 3 |
| 4 |
D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成,则D是Al元素,A为H元素,C为Na元素,根据元素、单质和化合物的性质来分析解答.
解答:解:A、B、C、D、E为五种短周期元素,它们的原子序数依次增大,A元素的原子半径最小,B元素原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,则B最外层6,次外层为2,B为O元素;
C与A同主族,且与E同周期,E元素的最外层电子数是次外层电子数的
倍,次外层为8个电子,最外层为6个电子,第一电子层为2个电子,且属于短周期元素,所以E是S元素,
D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成,则D是Al元素,A为H元素,C为Na元素,
(1)通过以上分析知,B为O元素,D为Al元素,
故答案为:O;Al;
(2)C与E形成化合物是Na2S,为离子化合物,所以形成的化学键是离子键,
故答案为:离子键;
(3)D为铝,C的氧化物的水化物是氢氧化钠,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)①氢氧燃料电池中,燃料失电子发生氧化反应,所以燃料所在的电极为负极,则a为负极,
故答案为:负;
②b为正极,正极上氧气得电子和水反应生成氢氧根离子,离子反应方程式为:O2+4e-+2H2O═4OH-,
故答案为:O2+4e-+2H2O═4OH-.
C与A同主族,且与E同周期,E元素的最外层电子数是次外层电子数的
| 3 |
| 4 |
D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成,则D是Al元素,A为H元素,C为Na元素,
(1)通过以上分析知,B为O元素,D为Al元素,
故答案为:O;Al;
(2)C与E形成化合物是Na2S,为离子化合物,所以形成的化学键是离子键,
故答案为:离子键;
(3)D为铝,C的氧化物的水化物是氢氧化钠,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,离子反应方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
(4)①氢氧燃料电池中,燃料失电子发生氧化反应,所以燃料所在的电极为负极,则a为负极,
故答案为:负;
②b为正极,正极上氧气得电子和水反应生成氢氧根离子,离子反应方程式为:O2+4e-+2H2O═4OH-,
故答案为:O2+4e-+2H2O═4OH-.
点评:本题考查了位置结构和性质的关系,正确推断元素是解本题关键,根据原电池原理、离子方程式的书写规则、化学键的判断方法来分析解答即可,难点是电极反应式的书写方法,难度中等.

练习册系列答案
相关题目
【化学--选修3:物质结构与性质】
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)G位于 族 区,价电子排布式为 .
(2)B基态原子中能量最高的电子,其电子云在空间有 个方向,原子轨道呈
形.
(3)画出C原子的电子排布图 .
(4)已知BA5为离子化合物,写出其电子式 .
(5)DE3中心原子的杂化方式为 ,用价层电子对互斥理论推测其空间构型为 .
(6)用电子式表示F元素与E元素形成化合物的形成过程 .
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
(2)B基态原子中能量最高的电子,其电子云在空间有
形.
(3)画出C原子的电子排布图
(4)已知BA5为离子化合物,写出其电子式
(5)DE3中心原子的杂化方式为
(6)用电子式表示F元素与E元素形成化合物的形成过程
 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:

