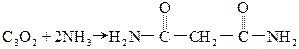题目内容
对金属锌与浓硫酸的反应来说,下列说法不当的是( )
| A.若金属锌足量,反应所放出的气体应为混合物 |
| B.反应消耗的锌的物质的量一定等于反应生成的气体的物质的量 |
| C.由于金属铝的活动性强于锌,所以铝与浓硫酸的反应一定比锌与浓硫酸反应剧烈 |
| D.反应中所转移的电子的物质的量一定等于反应生成的气体的物质的量2倍 |
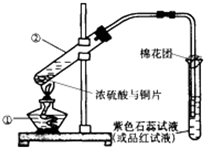
锌和浓硫酸反应方程式为:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,
A.锌和浓硫酸反应生成二氧化硫,随着反应的进行,浓硫酸变为稀硫酸时,二者反应生成氢气,所以生成的气体是混合物,故A正确;
B.根据Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑知,消耗锌的物质的量等于生成气体的物质的量,故B正确;
C.常温下,铝和浓硫酸发生钝化现象而阻止进一步反应,故C错误;
D.Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑中,转移电子和生成气体之间的物质的量之比=2:1,故D正确;
故选C.
A.锌和浓硫酸反应生成二氧化硫,随着反应的进行,浓硫酸变为稀硫酸时,二者反应生成氢气,所以生成的气体是混合物,故A正确;
B.根据Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑知,消耗锌的物质的量等于生成气体的物质的量,故B正确;
C.常温下,铝和浓硫酸发生钝化现象而阻止进一步反应,故C错误;
D.Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑中,转移电子和生成气体之间的物质的量之比=2:1,故D正确;
故选C.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目