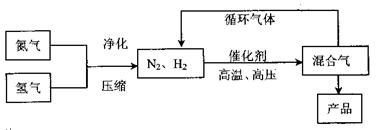
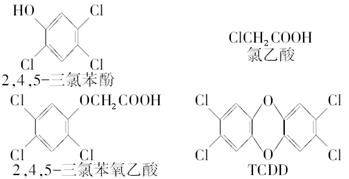
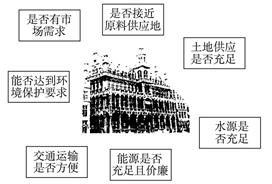
题目内容
下列六种工业生产:①用海水为原料提取镁 ②制硅酸盐水泥 ③制普通玻璃 ④冶炼生铁 ⑤制漂白粉 ⑥接触法制硫酸,其中必需用到石灰石作为原料的是
A.①②③④⑤ B.②③④⑤⑥
C.①②③⑤⑥ D.①②③④⑤⑥
D.④中的沉淀长时间放置会变成红褐色沉淀
A.①②③④⑤ B.②③④⑤⑥
C.①②③⑤⑥ D.①②③④⑤⑥
D.④中的沉淀长时间放置会变成红褐色沉淀
A
①用海水为原料提取镁中用石灰石作为原料生产Ca(OH)2②制硅酸盐水泥的原料是石灰石和黏土 ③制普通玻璃的原料是石灰石、纯碱、石英 ④冶炼生铁用石灰石造渣 ⑤制漂白粉用石灰石作为原料生产Ca(OH)2,只有⑥接触法制硫酸不用石灰石做原料。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 2NH3(g),其
2NH3(g),其