题目内容
(1)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号)________________。
(2)试比较含氧酸的酸性强弱(填“>”、“<”或“=”): HClO3________HClO4。
(3)根据价层电子对互斥理论判断:H2O的VSEPR构型为 。
(4)沸点比较:邻羟基苯甲醛 对羟基苯甲醛(填“>”、“<”或“=”),原因是__________
(1)②④(1分)
(2)< (1分)
(3)四面体形(1分)
(4)<(1分)
解析试题分析:(1)对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子。故非极性分子为②④。
(2)同种元素的元素的化合价越高,对应的含氧酸的酸性越强。
(3)H2O中心原子O原子成2个σ键、含有2对孤对电子,故杂化轨道数为4,VSEPR构型为四面体形。
(4)对羟基苯甲醛的沸点高于邻羟基苯甲醛,因为对羟基苯甲醛形成分子间氢键使沸点升高,而邻羟基苯甲醛形成的是分子内氢键 。
考点:氢键、价层电子互斥理论、化学键判断。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法一定正确的是
| A.其水溶液导电的一定是离子化合物 |
| B.熔融态导电的一定是离子化合物 |
| C.固态导电的一定是金属单质 |
| D.固态不导电但熔融态导电的一定是离子化合物 |
铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为________。
(2)如图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。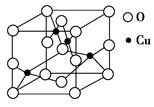
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下: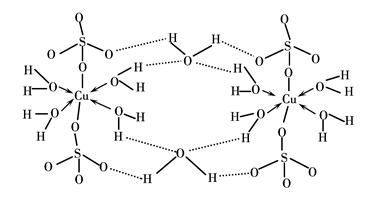
下列说法正确的是________(填字母)。
| A.在上述结构示意图中,所有氧原子都采用sp3杂化 |
| B.在上述结构示意图中,存在配位键、共价键和离子键 |
| C.胆矾是分子晶体,分子间存在氢键 |
| D.胆矾中的水在不同温度下会分步失去 |
NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_______________________________________________________________。
(5)Cu2O的熔点比Cu2S的________(填“高”或“低”),请解释原因_________________________________________________________________。
下列有关晶体的叙述中,错误的是
| A.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时化学键不被破坏 |
| B.白磷晶体中,结构粒子之间通过共价键结合 |
| C.石英晶体是直接由硅原子和氧原子通过共价键所形成的空间网状结构的晶体 |
| D.构成分子晶体的结构粒子中不一定存在共价键 |
