题目内容
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出B、C两种元素的元素名称:B ,C ,指出D在周期表中的位置 。
(2)D的气态氢化物与H2S、HF的稳定性由强到弱为 (用化学式表示)。
(3)写出淡黄色固体E的电子式 ,其中含有的化学键为 。
(4)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出KA2与CO2发生反应的化学方程式 。K2A2、KA2在医院、矿井、潜水、高空飞行中常用作供氧剂,为了维持气压稳定可以使用过氧化钾和超氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它
们的物质的量之比为 。
(1)B:钠; C:镁; 第三周期第ⅦA族; (2)HF > HCl > H2S ;
(3)Na2O2的电子式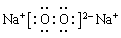 ; 离子键、非极性键(或共价键);
; 离子键、非极性键(或共价键);
(4)4KO2 + 2CO2 =2K2CO3 + 3O2 ; 1:2
【解析】
试题分析:A元素形成的—2价阴离子比氦原子的核外电子数多8个,则A是8号元素O;B元素与A元素可组成一种化合物E,为淡黄色固体,该固体遇到空气能生成A的单质,则B为Na元素;C为原子核内有12个中子的金属元素,当2.4gC与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;则C为Mg元素;D元素原子的M层上有7个电子。则D为Cl元素。(1)B、C两种元素的元素名称分别是B:钠;C:镁。Cl元素在周期表中的位置是位于第三周期第ⅦA族。(2)Cl、S是同一周期的元素,元素的非金属性Cl>S。元素的非金属性越强,其气态氢化物的稳定性就越强。所以气态氢化物HC>H2S;F、Cl是同一主族的元素。从上到下,元素的原子半径逐渐增大,元素的非金属性逐渐减弱。所以氢化物的稳定性HF >HCl。所以这些元素的氢化物稳定性由强到弱为HF > HCl > H2S。(3)淡黄色固体Na2O2的电子式为: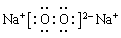 。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2 ;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
。Na2O2是离子化合物。在Na与O之间以离子键结合,在O、O之间以非极性共价键结合。所以Na2O2中含有的化学键为离子键、非极性键。(4)KO2与CO2发生反应的化学方程式为4KO2 + 2CO2 =2K2CO3 + 3O2 ;K2O2与CO2反应的方程式为:2K2O2 + 2CO2 =2K2CO3 + O2。若使吸收的CO2与生成的O2体积相同,则n(K2O2):n(KO2)=1:2.
考点:考查元素的推断、元素的金属性、非金属性的比较、物质的电子式、化学键、化学方程式的书写及混合物中组成成分含量的计算的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
