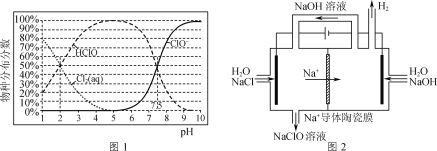
题目内容
【题目】CO2催化重整CH4的反应:(Ⅰ)CH4(g)+CO2(g)![]() 2CO(g)+2H2(g);ΔH1,
2CO(g)+2H2(g);ΔH1,
主要副反应:(Ⅱ)H2(g)+CO2(g)![]() CO(g)+H2O(g);ΔH2>0,
CO(g)+H2O(g);ΔH2>0,
(Ⅲ)4H2(g)+CO2(g)![]() CH4(g)+2H2O(g);ΔH3<0。
CH4(g)+2H2O(g);ΔH3<0。
在恒容反应器中按体积分数V(CH4)∶V(CO2)=50%∶50%充入气体,加入催化剂,测得反应器中平衡时各物质的体积分数与温度的关系如图所示。下列说法正确的是( )
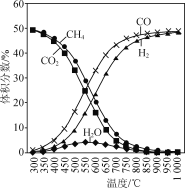
A.ΔH1=2ΔH2-ΔH3<0
B.其他条件不变,适当增大起始时V(CH4)∶V(CO2),可抑制副反应(Ⅱ)、(Ⅲ)的进行
C.300~580℃时,H2O的体积分数不断增大,是由于反应(Ⅲ)生成H2O的量大于反应(Ⅱ)消耗的量
D.T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则反应(Ⅰ)的平衡常数小于81
【答案】BD
【解析】
A. 反应(Ⅰ)可由2倍(Ⅱ)减去反应(Ⅲ)得到,故ΔH1=2ΔH2-ΔH3,再根据图示,随温度的升高,CH4和CO2的体积分数减小,说明升温,平衡正移,而升温平衡向吸热方向移,正反应吸热,ΔH1>0,A不正确;
B. 其他条件不变,适当增大起始时V(CH4)∶V(CO2),即增大CH4浓度和减小CO2浓度,根据平衡移动原理,减小反应物浓度或增加生成物浓度,平衡都逆向移动,B正确;
C. 300~580℃时,H2O的体积分数不断增大,反应(Ⅲ)是放热反应,升温时,平衡逆移消耗H2O,反应(Ⅱ)是吸热反应,升温时正移,生成H2O,而由于反应(Ⅲ)消耗H2O的量小于反应(Ⅱ)生成水的量,C错误;
D. T℃时,在2.0L容器中加入2mol CH4、2mol CO2以及催化剂进行重整反应,测得CO2的平衡转化率为75%,则CO2转化的浓度为![]() 根据三段式:
根据三段式:
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起 1mol/L 1mol/L 0 0
转0.75mol/L 0.75mol/L 1.5mol/L 1.5mol/L
平 0.25mol/L 0.25mol/L 1.5mol/L 1.5mol/L
若不考虑副反应,则反应(Ⅰ)的平衡常数![]() ,但由于副反应(Ⅲ)中,消耗的氢气的量比二氧化碳多的多,故计算式中,分子减小的更多,值小于81,D正确;
,但由于副反应(Ⅲ)中,消耗的氢气的量比二氧化碳多的多,故计算式中,分子减小的更多,值小于81,D正确;
答案选BD。

 口算题天天练系列答案
口算题天天练系列答案