题目内容
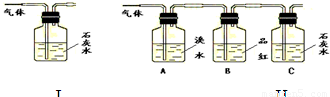
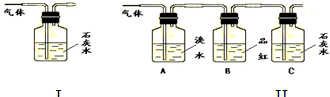
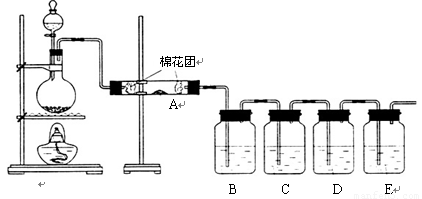
写出木炭与浓硫酸反应的化学方程式 .为了验证产物中的二氧化碳气体,甲、乙两同学分别设计如下实验(已知Br2+2H2O+SO2═H2SO4+2HBr):
请回答下列问题
(1)根据Ⅰ装置中石灰水变浑浊的现象能否说明产物中一定有二氧化碳气体?
,理由是 .
(2)Ⅱ装置中A的作用是 ;B的作用是 .
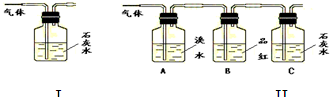
(3)根据B中品红 ,C中产生 ,说明产物中一定有二氧化碳气体.
【答案】分析:根据木炭粉与浓硫酸发生反应书写化学方程式;
检验S02和CO2混合气体中的二氧化碳,应排除二氧化硫的干扰,用氧化剂可把二氧化硫氧化,同时用品红溶液检验是否除尽,这样石灰水变浑浊才能说明有CO2.
解答:解:根据木炭粉与浓硫酸发生反应书写化学方程式:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(1)因S02和C02都能使石灰水变浑浊,因此要想检验出C02,应先除掉S02,这样石灰水变浑浊才能说明有C02.
故答案为:不能 因为SO2与石灰水反应生成CaSO3也难溶于水;
(2)因S02和C02都能使石灰水变浑浊,因此要想检验出C02,应先除掉S02.根据二氧化硫具有还原性,
可用溴水把二氧化硫吸收,反应方程式为:Br2+SO2+2H2O=2HBr+2H2SO4.可根据二氧化硫能使品红褪色来检验二氧化硫是否除尽.
故答案为:除去SO2 检验SO2是否已除净;
(3)要检验二氧化碳,应排除无二氧化硫,根据二氧化碳与澄清石灰水变浑浊来检验二氧化碳,
反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:B中品红不褪色 C中产生浑浊(或白色沉淀)
点评:本题重点考查了混合气体中二氧化碳的检验,一定要排除干扰气体的干扰,再进行检验,并利用物质的性质来解答.
检验S02和CO2混合气体中的二氧化碳,应排除二氧化硫的干扰,用氧化剂可把二氧化硫氧化,同时用品红溶液检验是否除尽,这样石灰水变浑浊才能说明有CO2.
解答:解:根据木炭粉与浓硫酸发生反应书写化学方程式:C+2H2SO4(浓)
 CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
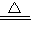 CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;(1)因S02和C02都能使石灰水变浑浊,因此要想检验出C02,应先除掉S02,这样石灰水变浑浊才能说明有C02.
故答案为:不能 因为SO2与石灰水反应生成CaSO3也难溶于水;
(2)因S02和C02都能使石灰水变浑浊,因此要想检验出C02,应先除掉S02.根据二氧化硫具有还原性,
可用溴水把二氧化硫吸收,反应方程式为:Br2+SO2+2H2O=2HBr+2H2SO4.可根据二氧化硫能使品红褪色来检验二氧化硫是否除尽.
故答案为:除去SO2 检验SO2是否已除净;
(3)要检验二氧化碳,应排除无二氧化硫,根据二氧化碳与澄清石灰水变浑浊来检验二氧化碳,
反应方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
故答案为:B中品红不褪色 C中产生浑浊(或白色沉淀)
点评:本题重点考查了混合气体中二氧化碳的检验,一定要排除干扰气体的干扰,再进行检验,并利用物质的性质来解答.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
 写出木炭与浓硫酸反应的化学方程式
写出木炭与浓硫酸反应的化学方程式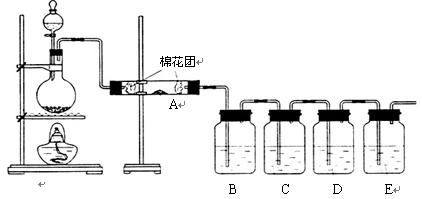
 写出木炭与浓硫酸反应的化学方程式______.
写出木炭与浓硫酸反应的化学方程式______.