题目内容
已知250C、101KPa下:①C(s)+![]() O2(g)=CO(g) △H=
O2(g)=CO(g) △H= ![]() Q1kJ/mol ②2CO(g)+ O2(g)=2CO2(g) △H=
Q1kJ/mol ②2CO(g)+ O2(g)=2CO2(g) △H=![]() Q2kJ/mol(Q1、Q2均为正数)据此推断,下列说法正确的是
Q2kJ/mol(Q1、Q2均为正数)据此推断,下列说法正确的是
A.碳的燃烧热为Q1kJ/mol
B. 2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量
C. 一定质量的碳燃烧,生成CO2(g)比生成 CO(g)时放出的热量多
D.碳燃烧生成CO2气体的热化学方程式为:C(s)+ O2(g)=CO2(g) △H= ![]() (Q1+Q2)kJ/mol
(Q1+Q2)kJ/mol
C
解析:A项,燃烧热是指1mol物质完全燃烧,生成稳定的化合物,所放出的热量。由于C(s)+![]() O2(g)=CO(g) △H=
O2(g)=CO(g) △H= ![]() Q1kJ/mol,生成的是CO,不是稳定的化合物,所以Q1kJ/mol不是碳的燃烧热;B项,反应②属于放热反应,只能说2molCO(g)和1molO2(g)所具有的能量一定高于2molCO2(g)所具有的能量;C项,生成CO2(g)是完全燃烧,而生成 CO(g)则是不完全燃烧,所以前者放出的热量多;D项,△H=
Q1kJ/mol,生成的是CO,不是稳定的化合物,所以Q1kJ/mol不是碳的燃烧热;B项,反应②属于放热反应,只能说2molCO(g)和1molO2(g)所具有的能量一定高于2molCO2(g)所具有的能量;C项,生成CO2(g)是完全燃烧,而生成 CO(g)则是不完全燃烧,所以前者放出的热量多;D项,△H= ![]() (2Q1+Q2)kJ/mol
(2Q1+Q2)kJ/mol

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
已知250C、101KPa下:①C(s)+
O2(g)=CO(g)△H=Q1kJ/mol ②2CO(g)+O2(g)=2CO2(g)
△H=Q2kJ/mol (Q1、Q2均为正数)据此推断,下列说法正确的是( )
| 1 |
| 2 |
△H=Q2kJ/mol (Q1、Q2均为正数)据此推断,下列说法正确的是( )
| A、碳的燃烧热为Q1kJ/mol |
| B、2molCO(g)所具有的能量一定高于2molCO2(g)所具有的能量 |
| C、一定质量的碳燃烧,生成CO2(g)比生成 CO(g)时放出的热量多 |
| D、碳燃烧生成CO2气体的热化学方程式为:C(s)+O2(g)=CO2(g)△H=(Q1+Q2)kJ/mol |
 O2(g)="CO(g) " △H=
O2(g)="CO(g) " △H= 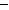 Q1kJ/mol ②2 CO(g)+ O2(g)=2CO2(g) △H=
Q1kJ/mol ②2 CO(g)+ O2(g)=2CO2(g) △H=