题目内容
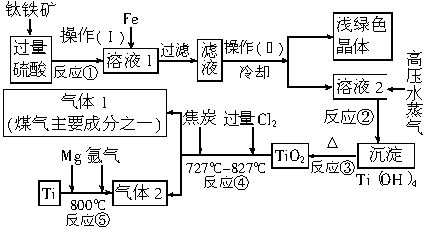
钛由于具有密度小,强度高,耐高温,抗腐蚀性强等优点,在现代科学技术上有着广泛的用途.工业上常用钛铁矿(主要成分为FeTiO3,同时含有铁的氧化物)为原料,经过一系列反应来制得钛,其工艺流程大致如下.阅读下述流程,完成下列填空:

(1)操作(I)中Fe的作用是
(2)操作(II)中冷却的目的是
(3)用FeSO4固体配制其溶液的正确方法是:
(4)将高压水蒸气通入溶液2的作用是
(5)由TiO2可经过反应=4*GB3 ④、=5*GB3 ⑤制取单质Ti,已知:C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol2CO(g)+O2(g)=2CO2(g);△H=-566kJ/molTiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ/mol则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=

(1)操作(I)中Fe的作用是
将Fe3+还原为Fe2+
将Fe3+还原为Fe2+
,该过程中所发生的离子反应方程式为Fe+2Fe3+=3Fe2+、Fe+2H+=H2↑+Fe2+
Fe+2Fe3+=3Fe2+、Fe+2H+=H2↑+Fe2+
.(2)操作(II)中冷却的目的是
析出FeSO4?7H2O
析出FeSO4?7H2O
.(3)用FeSO4固体配制其溶液的正确方法是:
FeSO4固体溶于稀H2SO4中,再加入少量铁粉
FeSO4固体溶于稀H2SO4中,再加入少量铁粉
.(4)将高压水蒸气通入溶液2的作用是
促进Ti4+离子完全水解生成沉淀
促进Ti4+离子完全水解生成沉淀
.其离子方程式为:Ti4++4H2O=Ti(OH)4↓+4H+
Ti4++4H2O=Ti(OH)4↓+4H+
.(5)由TiO2可经过反应=4*GB3 ④、=5*GB3 ⑤制取单质Ti,已知:C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol2CO(g)+O2(g)=2CO2(g);△H=-566kJ/molTiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ/mol则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)△H=
-80KJ/mol
-80KJ/mol
.反应⑤中Ar气的作用是作保护气,防止高温下镁和钛与空气中氧气
作保护气,防止高温下镁和钛与空气中氧气
.分析:(1)根据操作(II)可知产品之一为FeSO4?7H2O,所以操作(I)中要把Fe3+还原为Fe2+,根据溶液中的离子判断发生的反应,书写方程;
(2)操作(II)要把FeSO4从溶液中析出;
(3)用FeSO4固体配制其溶液时要考虑二价铁离子易水解和还原性,;
(4)让Ti4+转化为Ti(OH)4,根据反应物和产物书写其离子方程式;
(5)根据盖斯定律计算反应的焓变;反应⑤中是高温下的反应,镁和钛容易与空气中的氧气反应.
(2)操作(II)要把FeSO4从溶液中析出;
(3)用FeSO4固体配制其溶液时要考虑二价铁离子易水解和还原性,;
(4)让Ti4+转化为Ti(OH)4,根据反应物和产物书写其离子方程式;
(5)根据盖斯定律计算反应的焓变;反应⑤中是高温下的反应,镁和钛容易与空气中的氧气反应.
解答:解:(1)根据操作(II)可知产品之一为FeSO4?7H2O,所以操作(I)中要把Fe3+还原为Fe2+,溶液中能与Fe反应的离子有Fe3+和H+,所以其离子方程为:Fe+2Fe3+=3Fe2+、Fe+2H+=H2↑+Fe2+;故答案为:将Fe3+还原为Fe2+;Fe+2Fe3+=3Fe2+、Fe+2H+=H2↑+Fe2+;
(2)操作(II)要把FeSO4从溶液中析出,操作(II)中冷却的目的是:析出FeSO4?7H2O,故答案为:析出FeSO4?7H2O;
(3)用FeSO4固体配制其溶液时要考虑二价铁离子易水解和还原性,所以要加入稀硫酸防止二价铁离子水解,加入铁粉,防止二价铁离子被氧化,因此用FeSO4固体配制其溶液的正确方法是:FeSO4固体溶于稀H2SO4中,再加入少量铁粉,
故答案为:FeSO4固体溶于稀H2SO4中,再加入少量铁粉;
(4)让Ti4+转化为Ti(OH)4,Ti4+与水反应生成Ti(OH)4沉淀,其离子方程式为:Ti4++4H2O=Ti(OH)4↓+4H+;
故答案为:促进Ti4+离子完全水解生成沉淀;Ti4++4H2O=Ti(OH)4↓+4H+;
(5)已知①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1
TiO2和焦炭、氯气反应生成TiCl4和CO气体的化学方程式为:2C+TiO2+2Cl2═TiCl4+2CO,
由盖斯定律可知2×①-②+③得到2C+TiO2+2Cl2═TiCl4+2CO,
其△H=2×(-393.5kJ?mol-1)+566kJ?mol-1+141kJ?mol-1+(=-221kJ?mol-1)=-80kJ?mol-1.
反应⑤中是高温下的反应,镁和钛容易与空气中的氧气反应,所以通入Ar气作保护气;
故答案为:-80kJ?mol-1;作保护气,防止高温下镁和钛与空气中氧气.
(2)操作(II)要把FeSO4从溶液中析出,操作(II)中冷却的目的是:析出FeSO4?7H2O,故答案为:析出FeSO4?7H2O;
(3)用FeSO4固体配制其溶液时要考虑二价铁离子易水解和还原性,所以要加入稀硫酸防止二价铁离子水解,加入铁粉,防止二价铁离子被氧化,因此用FeSO4固体配制其溶液的正确方法是:FeSO4固体溶于稀H2SO4中,再加入少量铁粉,
故答案为:FeSO4固体溶于稀H2SO4中,再加入少量铁粉;
(4)让Ti4+转化为Ti(OH)4,Ti4+与水反应生成Ti(OH)4沉淀,其离子方程式为:Ti4++4H2O=Ti(OH)4↓+4H+;
故答案为:促进Ti4+离子完全水解生成沉淀;Ti4++4H2O=Ti(OH)4↓+4H+;
(5)已知①C(s)+O2(g)=CO2(g);△H=-393.5kJ?mol-1
②2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g);△H=+141kJ?mol-1
TiO2和焦炭、氯气反应生成TiCl4和CO气体的化学方程式为:2C+TiO2+2Cl2═TiCl4+2CO,
由盖斯定律可知2×①-②+③得到2C+TiO2+2Cl2═TiCl4+2CO,
其△H=2×(-393.5kJ?mol-1)+566kJ?mol-1+141kJ?mol-1+(=-221kJ?mol-1)=-80kJ?mol-1.
反应⑤中是高温下的反应,镁和钛容易与空气中的氧气反应,所以通入Ar气作保护气;
故答案为:-80kJ?mol-1;作保护气,防止高温下镁和钛与空气中氧气.
点评:本题考查化学工艺流程,同时考查盖斯定律的应用,溶液的配制,离子方程式的书写,题目难度较大,做题时注意从物质的性质角度结合题中信息解答.

练习册系列答案
相关题目