题目内容
下列有关物质性质的说法错误的是
| A.热稳定性:HCl> HI | B.原子半径:Na> Mg |
| C.酸性:H2SO3>H2SO4。 | D.结合质子能力:S2-> Cl- |
C
解析试题分析:A.元素的非金属性越强,其氢化物的稳定性就越强。元素的非金属性Cl>I.所以稳定性HCl> HI。B.Na、Mg是同一周期的元素。同一周期的元素,元素的原子序数越小,原子半径就越大。因此原子半径:Na> Mg。正确。C.H2SO3是中强酸,H2SO4是强酸,所以酸性:H2SO4> H2SO3。错误。D.元素的非金属性越强,其简单离子结合氢离子的浓度就越弱。非金属性Cl>S,所以结合质子能力:S2-> Cl-。正确。
考点:考查元素周期表、元素周期律的知识。

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
下列各组原子中,化学性质一定相似的是
| A.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子 |
| B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅两个电子的Y原子 |
| C.2p轨道上只有一个空轨道的X原子与3p轨道上只有一个空轨道的Y原子 |
| D.最外层都只有一个电子的X、Y原子 |
下列判断中一定正确的是
| A.若X、Y都是气态氢化物,且相对分子质量:X﹥Y,则沸点:X﹥Y |
| B.若X、Y属于同主族元素,且相对原子质量:X﹥Y,则X的失电子能力比Y强 |
| C.若R2-和M+的电子层结构相同,则原子序数:R﹥M |
| D.若M、N是同主族元素,且原子序数:M﹥N,则非金属性:M﹥N |
对发现元素周期律贡献最大的化学家是 ( )
| A.牛顿 | B.道尔顿 | C.阿伏加德罗 | D.门捷列夫 |
下列事实一般不能用于判断金属性强弱的是( )
| A.金属的颜色和熔沸点 |
| B.金属元素的最高价氧化物对应的水化物的碱性强弱 |
| C.1mo金属单质在反应中失去电子的多少 |
| D.金属元素的单质和水或酸置换出氢的难易 |
下列各组中两种微粒所含电子数不相等的是
| A.H3O+和OH- | B.CO和N2 | C.HNO2和NO2- | D.CH3+和NH4+ |
下列表示方法正确的是
A.铜的原子结构示意图: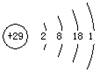 |
| B.S2- 核外电子排布式:[Ne] 2s23p6 |
C.O原子处于基态的轨道表示式: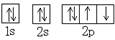 |
D.用电子式表示MgCl2的形成:Mg:+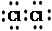 → →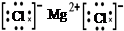 |
下列化学用语表示正确的是
| A.原子核中有6个中子的硼原子:6 B | B.HCl的电子式: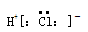 |
C.K+结构示意图: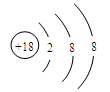 | D.HClO的结构式:H—O—Cl |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是( )
| R | T | |
| X | Y | Z |
A.X位于元素周期表中第三周期第VIA族
B.Z元素的气态氢化物为极性分子
C.Y元素最高价氧化物对应水化物为强酸
D.五种元素中原子半径最大的是R