题目内容
在某固定容积的密闭容器中存在化学平衡:a A(g)![]() b B(g)+c C(g),在温度不变的条件下,再充入一定量的A 物质,重新达到平衡时,下列判断中正确的是( )
b B(g)+c C(g),在温度不变的条件下,再充入一定量的A 物质,重新达到平衡时,下列判断中正确的是( )
A.若a=b+c时,B的物质的量分数变大
B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变
D.若a<b+c时,A的转化率变小
BD
解析:
对于只有一种反应物的可逆反应,增加A的量,相当于增大体系的压强,平衡向正反应方向移动,但该反应质A的转化率的变化与气体物质的系数有关。①若a=b+c,A的转化率不变,反应混合物的含量保持不变,故A项错误,B项正确;②若a>b+c,A的转化率增大,故C项错误;③若a<b+c,A的转化率减小,故D项正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
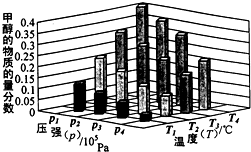 能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.
能源是制约国家发展进程的因素之一.甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚.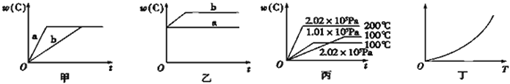







 xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t) 的关系。
xC(g)的生成物C在反应混合物中的百分含量(C%)和反应时间(t) 的关系。