题目内容
按Cl-Br-I顺序,下列递变规律中正确的是( )
| A、单质的熔沸点逐渐降低 |
| B、卤素离子的还原性逐渐增强 |
| C、气态氢化物的稳定性逐渐增强 |
| D、单质的氧化性逐渐增强 |
考点:卤素原子结构及其性质的比较
专题:元素周期律与元素周期表专题,卤族元素
分析:F、Cl、Br、I同为第VIIA族元素,同主族从上到下,非金属性逐渐减弱,单质的氧化性减弱,与氢气化合越来越困难,离子的还原性增强,单质的熔、沸点逐渐升高,据此分析.
解答:
解:A.氟、氯、溴、碘,单质的熔、沸点逐渐升高,故A错误;
B.非金属性越强则单质的氧化性越强,对应离子的还原性越弱,所以卤素离子的还原性逐渐增强,故B正确;
C.F、Cl、Br、I非金属性逐渐减弱,对应的气态氢化物的稳定性逐渐减弱,故C错误;
D.F、Cl、Br、I非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故D错误.
故选B.
B.非金属性越强则单质的氧化性越强,对应离子的还原性越弱,所以卤素离子的还原性逐渐增强,故B正确;
C.F、Cl、Br、I非金属性逐渐减弱,对应的气态氢化物的稳定性逐渐减弱,故C错误;
D.F、Cl、Br、I非金属性逐渐减弱,对应单质的氧化性逐渐减弱,故D错误.
故选B.
点评:本题考查元素周期律,同主族元素非金属性的强弱的变化规律是解答本题的关键,熟悉元素周期律即可解答,难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
(双选)下列物质中互为同分异构体的是( )
A、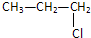 |
B、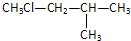 |
C、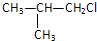 |
| D、CH3CH2CH2CH2Cl |
在pH相同的氢氧化钾和氨水两种溶液中( )
| A、H+的物质的量浓度相同 |
| B、溶质的物质的量浓度相同 |
| C、OH-的物质的量相同 |
| D、最多可中和硫酸的物质的量相同 |
下列实验操作中一定会造成误差的是( )
| A、将pH试纸用蒸馏水湿润后测某溶液的pH |
| B、在中和热的测定实验中用Ba(OH)2代替NaOH;H2SO4代替HCl |
| C、用碱石灰来干燥氨气 |
| D、使用托盘天平称量时将药品放在天平的右盘与砝码放在天平的左盘 |
已知:2NO2(g) N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
 N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)
N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g) N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是( )| A、减小NO2的浓度 |
| B、降低温度 |
| C、增加压强 |
| D、升高温度 |
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |