题目内容
下列物质中,不含结晶水的是
[ ]
A.芒硝
B.大理石
C.明矾
D.生石膏
答案:B
解析:
提示:
解析:
|
解析:大理石的主要成份是 |
提示:
|
大理石的主要成份是 |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
| Ⅰ:下列有关实验的描述不正确的是____(填序号); ①用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准溶液润洗,则测定结果偏低。 ② 配制一定物质的量浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高; ③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末 ④ 硝酸钾过饱和溶液冷却未出现结晶时,可以用玻棒充分磨擦器皿壁促使晶体析出。 ⑤可用25ml酸式滴定管量取20.00mlKMnO4溶液 ⑥分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多 Ⅱ:三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通 过实验来探究红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下: 查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。 提出假设 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O 假设3:红色粉末是Fe2O3和Cu2O的混合物 设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。 (1)若假设1成立,则实验现象是_________________。 (2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?_________________。简述你的理由(不需写出反应的方程式)___________________。 (3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是____________,写出发生反应的离子方程式________________。 探究延伸 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。 (4)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为________。 (5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: | ||||||||||||
| ||||||||||||
| 实验室有下列试剂可供选择: A、氯水 B、H2O2 C、NaOH D、Cu2(OH)2CO3 实验小组设计如下方案 | ||||||||||||
 | ||||||||||||
| 试回答: ①试剂1为_______,试剂2为________(填字母)。 ②固体X的化学式为____________。 ③操作I为___________。 |
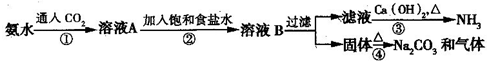
 (2010?西城区模拟)物质A、B的溶解度曲线如右图所示(A、B均不与水反应且不含结晶水).下列叙述中,正确的是
(2010?西城区模拟)物质A、B的溶解度曲线如右图所示(A、B均不与水反应且不含结晶水).下列叙述中,正确的是
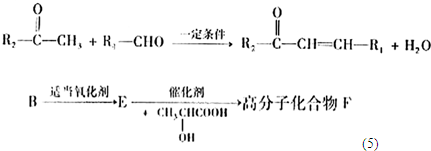
 +
+
 +H2O
+H2O
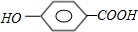 +n
+n
 +(2n-1)H2O
+(2n-1)H2O +(2n-1)H2O
+(2n-1)H2O