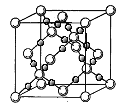
题目内容
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2 min末/mol[ | 0.8 | 2.7 | 0.8 | 2.7 |
3 min末/mol | 0.8 |
已知2 min内v(Q)=0.075 mol·L-1·min-1,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
【答案】
(1)2.3 mol 3 mol
(2)1 4 2 3
(3)0.05 mol·L -1·min -1
【解析】
试题分析:对比X的起始量和2 min末的量,可知反应逆向进行。
Δn(Q)=v(Q)·V·Δt=0.075 mol·L -1 ·min -1 ×2 L×2 min=0.3 mol。
对反应过程作三段式法分析如下:
mX + nY![]() pZ + qQ
pZ + qQ
始/mol 0.7 n(Y) 1 n(Q)
变/mol Δn(X) Δn(Y) Δn(Z) 0.3
2 min末/mol 0.8 2. 7 0.8 2.7
故Δn(X)=0.8 mol-0.7 mol=0.1 mol
Δn(Z)=1 mol-0.8 mol=0.2 mol
n(Q)=0.3 mol+2.7 mol=3 mol
(1)因![]() ,v(Y)=2v(Z)=
,v(Y)=2v(Z)= ![]() ×2=
×2= ![]() ×2= 0.1mol·L -1·min -1
×2= 0.1mol·L -1·min -1
所以Δn(Y)=0.1 mol·L -1 ·min -1 ×2 min×2 L=0.4 mol,
n(Y)=2.7 mol-0.4 mol=2.3 mol;n(Q)=0.3 mol+2.7 mol=3 mol。
(2)m∶n∶p∶q=Δn(X)∶Δn(Y)∶Δn(Z)∶Δn(Q)=0.1 mol∶0.4 mol∶0.2 mol∶0.3 mol=1∶4∶2∶3
(3)v(Q)=0.075 mol·L -1 ·min -1,故v(Z)=0.05 mol·L -1·min -1 。

【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
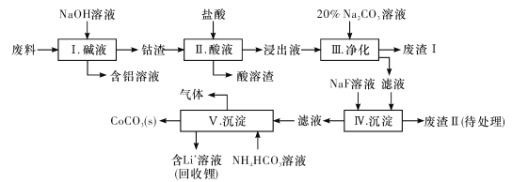
已知:①物质溶解性:LiF、CoCO3难溶于水,Li2CO3微溶于水;
② Co2O3有强氧化性,能氧化盐酸;
③ 部分金属离子形成氢氧化物沉淀的pH见下表:
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1) 步骤I中得到含铝溶液的反应的离子方程式是________________。
(2) 步骤D中加人盐酸的作用是________________。
(3) 步骤III中Na2CO3溶液的作用是调节溶液的PH,应使溶液的pH控制在_____(填范围),废渣I中的成分有________________。
(4) 步骤V中产生CoCO3的离子方程式是________________。
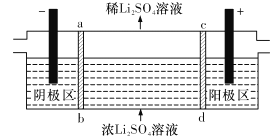
(5) 滤渣II用硫酸处理后用三室式电渗析法电解可得LiOH溶液和稀硫酸。则离子交换膜c为__________(填“阴”或“阳”)离子交换膜,随着电解的进行,阴极区pH将_________(填“增大”、“减小”或“不变”)。
(6) 向所得LiOH溶液中加入NH4HCO3即可得到Li2CO3。工业上以碳酸锂和碳酸钴在空气中高温煅烧制备锂离子电池的正极材料钴酸锂 (LiCoO2)时,还会产生一种三原子构成的直线型气体分子,该分子的电子式为_______________,写出工业上用上述方法制备钴酸锂的化学反应方程式___________________。
(7) 某锂离子充电时电池的总反应为C6+ LiCoO2==LixC6+Li1-xCoO2,该锂离子电池放电时正极的电极反应式为__________________。