题目内容
【题目】氰化钠(NaCN)是重要的化工原料,常用于化学合成、冶金工业等。回答下列问题:
(1)下列标志中,应贴在装有氰化钠容器上的是 。

(2)写出NaCN的电子式 。
(3)可用纯碱、焦炭、氨气反应制取NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目 。
(4)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[ Au(CN)2]生成金。“浸取”反应的氧化剂是 ,消耗的锌与生成的金的物质的量之比为 。
(5)工业利用NaCN制备蓝色染料的流程如下:
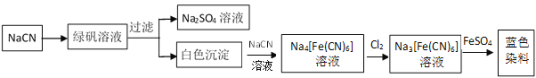
通入Cl2时发生反应的离子方程式为_ _,该蓝色染料的化学式为 。
【答案】(1)A (2)![]()
(3)
(4)氧气 1:2
(5)2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-;Fe3[Fe(CN)6]2
【解析】
试题分析:(1)NaCN是有剧毒的药品,应贴在装有氰化钠容器上的是剧毒标志,故选A;
(2)NaCN为离子化合物,电子式为![]() ;
;
(3)根据元素守恒可知,纯碱、焦炭、氨气反应制取 NaCN,同时会生成水,反应的化学方程式,并用单线桥标明电 子转移的方向和数目为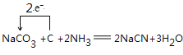 ;
;
(4)根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2]( 二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2 O+O2=4Na[Au(CN)2]+4NaOH,所以氧化剂是氧气,还原1mol金要转移1mol电子,而每mol锌能转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2;
(5)根据工业流程可知,NaCN与FeSO4反应生成Fe(CN)2白色沉淀,Fe(CN)2继续与NaCN溶液反应生成Na4[Fe(CN)6],Na4[Fe(CN)6]被氯气氧化成Na3[Fe(CN)6],反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-,Na3[Fe(CN)6]与硫酸亚铁反应生成蓝色染料为Fe3[Fe(CN)6]2。

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案