题目内容
(1)SO2可用于工业生产SO3.
①在一定条件下,每生成8gSO3 气体,放热9.83kJ.该反应的热化学方程式为
②在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2mol SO2和1mol O2.甲保持压强不变,乙保持容积不变,充分反应后均达到平衡.
Ⅰ.平衡时,两容器中SO3体积分数的关系为:甲
Ⅱ.若乙在t1min时达到平衡,此时测得容器乙中的转SO2化率为90%,则该反应的平衡常数为
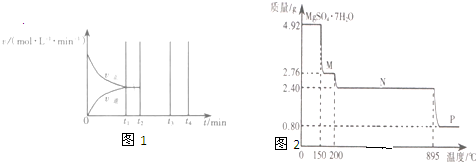
(2)硫酸镁晶体(MgSO4?7H2O)在制革、医药等 领域均有广泛用途.4.92g硫酸镁晶体受 热脱水过程的热重曲线(固体质量随温度 变化的曲线)如图2所示.
①固体M的化学式为
②硫酸镁晶体受热失去结晶水的过程分为
③N转化成P时,同时生成另一种氧化物,该反应的化学方程式为
②Ⅰ.2SO2(g)+O2(g)?2SO3(g)正反应是一体积缩小的反应,甲保持压强不变,乙保持容积不变,充分反应后均达到平衡,甲相当于乙容器到达平衡后的加压;
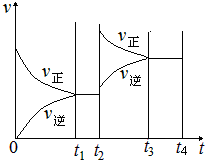
Ⅱ.根据平衡常数的表达式及达到平衡时各组分的浓度计算出该反应的平衡常数,平衡常数指各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;保持温度不变t2min时,再向该容器中充入1molSO2 和1mol SO3,正逆反应速率都增大,该温度下,此反应的化学平衡常数为810 L/mol,根据浓度商Qc与平衡常数K大小分析判断,Qc<Kc,平衡向正反应进行,Qc>Kc,平衡向逆反应进行,Qc═Kc,达平衡,该平衡向正反应方向移动;
(2)①依据图象数据和硫酸镁晶体加热失去结晶水150℃质量变化计算分析判断;
②依据图象数据和硫酸镁晶体加热失去结晶水150℃和200℃时的质量变化计算分析判断;
③硫酸镁晶体(MgSO4?7H2O)加热到200℃N时固体为硫酸镁,硫酸镁只含三种元素,N转化成P时,同时生成另一种氧化物,另一种氧化物只能是硫的氧化物,因镁的化合价未变,所以氧化物为三氧化硫,可通过N转化成P时图象数据计算进一步验证.
| m |
| M |
| 8g |
| 80g/mol |
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-196.6 kJ/mol;
②I.2SO2(g)+O2(g)?2SO3(g)正反应是一体积缩小的反应,在500℃,催化剂存在的条件下,向容积为1L的甲、乙两个密闭容器中均充入 2mol SO2和1mol O2,起始时,甲、乙两容器体积相同,甲保持压强不变,乙保持容积不变,充分反应后均达到平衡,甲为了保持压强不变,容器的体积不断减小,这一过程相当于到达平衡后的乙对甲容器加压,加压平衡正移.因此,达平衡时,甲容器中SO3体积分数大于乙容器中的三氧化硫,
故答案为:>;
II.乙在t1min时达到平衡,此时测得容器乙中的转SO2化率为90%,则2mol SO2和1mol O2在1L密闭容器在t1min内各物质浓度发生的变化如下:
2SO2(g)+O2(g)═2SO3(g),
起始浓度(mol/L) 2 1 0
变化浓度(mol/L) 1.8 0.9 1.8
平衡浓度(mol/L) 0.2 0.1 1.8
该反应的平衡常数为:k=
| C2(SO3) |
| C2(SO2)×C(O2) |
| (1.8mol/L)2 |
| (0.2mol/L)2×(0.1mol/L) |
保持温度不变t2min时,化学平衡常数不变,再向该容器中充入1molSO2 和1mol SO3,反应物SO2和生成物SO3,浓度在t2时都瞬间增加,所以t2时瞬间反应速率增大,在1L密闭容器在t2min内各物质浓度如下:
2SO2(g)+O2(g)═2SO3(g),
起始浓度(mol/L) 1.2 0.1 2.8 此时浓度商为:QC=
| C2(SO3) |
| C2(SO2)×C(O2) |
| (2.8mol/L)2 |
| (1.2mol/L)2×(0.1mol/L) |
 ,
,故答案为:810 L/mol;
 ;
; (2)①依据图象分析在150℃时固体质量变为2.76g,硫酸镁晶体加热失去结晶水,质量减小,设失去结晶水x个,则4.92g MgSO4?7H2O样品物质的量=
| 4.92g |
| 246g/mol |
| ||
0.02mol 0.02xmol 0.02xmol×18g/mol=4.92g-2.76g=2.16g x=6 所以加热到150℃时固体为MgSO4?H2O
故答案为:MgSO4?H2O;
②依据图象分析在200℃时固体质量变为2.40g,硫酸镁晶体加热失去结晶水,质量减小,设失去结晶水Y个,
MgSO4?7H2O
| ||
0.02mol 0.02Ymol 0.02Ymol×18g/mol=4.92g-2.40g=2.52g x=7 所以加热到200℃时固体为MgSO4,所以硫酸镁晶体受热失去结晶水的过程分为两个阶段,
故答案为:2;
③硫酸镁晶体(MgSO4?7H2O)加热到200℃N时固体为硫酸镁,硫酸镁只含三种元素,N转化成P时,同时生成另一种氧化物,另一种氧化物只能是硫的氧化物,因镁的化合价未变,所以氧化物为三氧化硫,从图象中可知P时,固体质量为0.8克,氧化镁的物质的量为
| 0.8g |
| 40g/mol |
| 0.96g |
| 16g/mol |
| ||
故答案为:MgSO4
| ||

含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2。
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数。
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取
研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100 mL滴有淀粉的
蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体
积为20.00mL。求该黄铜矿的纯度。
(2)将FeS和Fe2O3的混和物56.6 g,用足量稀H2SO4溶解后可得3.2 g硫,原混和物中FeS的质量。
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧
化钠溶液吸收。利用下图装置加热无水硫酸铜粉末直至完全分解。若无水硫酸铜粉末质量为10.0 g,
完全分解后,各装置的质量变化关系如下表所示。
|
装置 |
A(试管+粉末) |
B |
C |
|
反应前 |
42.0 g |
75.0 g |
140.0 g |
|
反应后 |
37.0 g |
79.0 g |
140.5 g |

请通过计算,推断出该实验条件下硫酸铜分解的化学方程式。
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4
+ 4C Na2S + 4CO↑ ②Na2SO4
+ 4CO
Na2S + 4CO↑ ②Na2SO4
+ 4CO Na2S + 4CO2
Na2S + 4CO2
a.若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量。
b.硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量。
 含有硫的化合物在工业生产中应用广泛,回答下列问题:
含有硫的化合物在工业生产中应用广泛,回答下列问题:
(1)黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2.
①测得某黄铜矿(CuFeS2)中含硫20%(质量分数),求该矿石含铜的质量分数.
②现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:称取研细的黄铜矿样品1.150g,在空气中进行煅烧,生成Cu、Fe3O4和SO2气体,用100mL滴有淀粉的蒸馏水全部吸收SO2,然后取10mL吸收液,用0.05mol/L标准碘溶液进行滴定,用去标准碘溶液的体积为20.00mL.求该黄铜矿的纯度.
(2)将FeS和Fe2O3的混和物56.6g,用足量稀H2SO4溶解后可得3.2g硫,求原混和物中FeS的质量.
(3)一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2.已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收.利用下图装置加热无水硫酸铜粉末直至完全分解.若无水硫酸铜粉末质量为10.0g,完全分解后,各装置的质量变化关系如下表所示.
| 装置 | A (试管+粉末) | B | C |
| 反应前 | 42.0g | 75.0g | 140.0g |
| 反应后 | 37.0g | 79.0g | 140.5g |
(4)硫化钠是用于皮革的重要化学试剂,可用无水Na2SO4与炭粉在高温下反应制得,化学方程式如下:
①Na2SO4+4C
 Na2S+4CO ②Na2SO4+4CO
Na2S+4CO ②Na2SO4+4CO Na2S+4CO2
Na2S+4CO2①若在反应过程中,产生CO和CO2混合气体为2mol,求生成Na2S的物质的量.
②硫化钠晶体放置在空气中,会缓慢氧化成Na2SO3,甚至是Na2SO4,现将43.72g部分变质的硫化钠样品溶于水中,加入足量盐酸后,过滤得4.8g沉淀和1.12L H2S 气体(标准状况,假设溶液中气体全部逸出),在滤液中加入足量的BaCl2后过滤得2.33g沉淀,分析该硫化钠样品的成分及其物质的量.
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: