题目内容
向1L 0.3mol/L的NaOH溶液中通入标准状况下CO2 4.48L,下列关系不正确的是( )
分析:n(NaOH)=0.3mol,n(CO2)=
=0.2mol,二者发生CO2+3OH-=HCO3-+CO32-+H2O,生成等物质的量的NaHCO3和Na2CO3,溶液水解呈碱性,且水解程度CO32->HCO3-,结合结合CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,以及电荷守恒、物料守恒解答该题.
| 4.48L |
| 22.4L/mol |
解答:解:n(NaOH)=0.3mol,n(CO2)=
=0.2mol,二者发生CO2+3OH-=HCO3-+CO32-+H2O,生成等物质的量的NaHCO3和Na2CO3,溶液水解呈碱性,且水解程度CO32->HCO3-,结合结合CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
A.溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A错误;
B.n(CO32-)+n(HCO3-)+n(H2CO3)=0.2mol,n(Na+)=0.3mol,根据物料守恒得,2C(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)],故B正确;
C.n(CO32-)+n(HCO3-)+n(H2CO3)=0.2mol,n(Na+)=0.3mol,又存在①CO32-+H2O?HCO3-+OH-,②HCO3-+H2O?H2CO3+OH-,水解程度①>②且水解程度都较小,则c(HCO3-)>c(CO32-)>c(OH-),则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C正确;
D.根据阴阳离子所带电荷相等得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①,根据物料守恒得2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]②,将方程式②-①×2得2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确.
故选A.
| 4.48L |
| 22.4L/mol |
A.溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A错误;
B.n(CO32-)+n(HCO3-)+n(H2CO3)=0.2mol,n(Na+)=0.3mol,根据物料守恒得,2C(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)],故B正确;
C.n(CO32-)+n(HCO3-)+n(H2CO3)=0.2mol,n(Na+)=0.3mol,又存在①CO32-+H2O?HCO3-+OH-,②HCO3-+H2O?H2CO3+OH-,水解程度①>②且水解程度都较小,则c(HCO3-)>c(CO32-)>c(OH-),则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C正确;
D.根据阴阳离子所带电荷相等得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①,根据物料守恒得2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]②,将方程式②-①×2得2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确.
故选A.
点评:本题考查离子浓度大小比较,为高考常见题型,侧重于学生的分析能力和计算能力的考查,题目难度较大,本题注意根据反应物的物质的量判断生成物的关系,结合盐类的水解判断.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

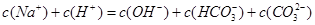
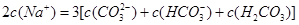

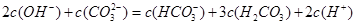
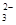 )>C(HCO
)>C(HCO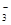 )>C(OH-)>C(H+)
)>C(OH-)>C(H+)