题目内容
向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,下列说法中不正确的是( )A.溶质为Na2CO3和NaOH
B.溶质为Na2CO3和NaHCO3
C.2c(Na+)/3=c(HCO3-)+c(CO32-)+c(H2CO3)
D.c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)
【答案】分析:向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,发生反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O,n(CO2):n(NaOH)=2:3=1:1.5,介于1:1与1:2之间,所以两个反应都发生.溶液为Na2CO3和NaHCO3.结合物料守恒与电荷守恒判断.
解答:解:向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,n(CO2):n(NaOH)=2:3=1:1.5,介于1:1与1:2之间,反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O都发生.溶液为Na2CO3和NaHCO3.
A、由上述分析可知,溶液为Na2CO3和NaHCO3,故A错误;
B、由上述分析可知,溶液为Na2CO3和NaHCO3,故B正确;
C、由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,
所以 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C正确;
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C正确;
D、根据溶液电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),
所以c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故D正确.
故选:A.
点评:考查根据方程式计算、离子浓度的比较,难度中等,判断二氧化碳与氢氧化钠的反应是解题关键.
解答:解:向1L 0.3mol/L的NaOH溶液中缓缓通入CO2气体至溶液增重8.8g,则增重的8.8g为二氧化碳的质量,物质的量为0.2mol,n(CO2):n(NaOH)=2:3=1:1.5,介于1:1与1:2之间,反应CO2+NaOH=NaHCO3,CO2+2NaOH=Na2CO3+H2O都发生.溶液为Na2CO3和NaHCO3.
A、由上述分析可知,溶液为Na2CO3和NaHCO3,故A错误;
B、由上述分析可知,溶液为Na2CO3和NaHCO3,故B正确;
C、由碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.2mol/L,溶液中c(Na+)=0.3mol/L,
所以
 c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C正确;
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故C正确;D、根据溶液电荷守恒c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),
所以c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故D正确.
故选:A.
点评:考查根据方程式计算、离子浓度的比较,难度中等,判断二氧化碳与氢氧化钠的反应是解题关键.

练习册系列答案
 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目

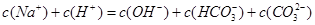
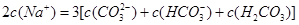

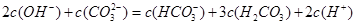
 )>C(HCO
)>C(HCO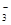 )>C(OH-)>C(H+)
)>C(OH-)>C(H+)