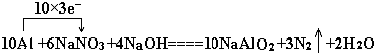题目内容
18.下列离子方程式正确的是( )| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
分析 A.磁性氧化铁为四氧化三铁,与硝酸发生氧化还原反应生成硝酸铁、NO和水;
B.反应生成氢氧化铝和碳酸氢钠;
C.电荷、原子不守恒;
D.强碱溶液中不能生成H+.
解答 解:A.磁性氧化铁溶于稀硝酸的离子反应为3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故A错误;
B.向NaAlO2溶液中通入过量CO2制Al(OH)3的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故B正确;
C.用浓盐酸与MnO2反应制取少量氯气的离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故C错误;
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子反应为4OH-+3ClO-+2Fe(OH)3═2FeO42-+3Cl-+5H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
8.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2.下列对该溶液的叙述中,不正确是( )
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-10mol/L | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 |
3.在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,一明反应A(s)+2B(g)?C(g)+D(g)已达到平衡状态.①各气体物质的量浓度;②气体的总物质的量;③混合气体的平均摩尔质量;④混合气体的密度( )
| A. | 只有①② | B. | 只有①④ | C. | 只有①③④ | D. | ①②③④ |
7.下列叙述错误的是( )
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 物质的量是度量物质所含微观粒子多少的物理量 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 等质量的O2和O3中所含氧原子个数相同 |
5.过氧化钙难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等.
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:
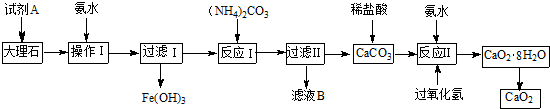
请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用c.
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是取上层清液少许于试管中,滴加KSCN溶液,若溶液不变红,则铁元素已除净.
(3)滤液B主要成分的化学式是NH4Cl.
(4)反应Ⅱ是放热反应.保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降.试分析CaO2产率下降的可能原因是H2O2浓度高,反应速率快,反应放热使体系升温迅速,促使H2O2分解.
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入10mL蒸馏水和20mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000mol•L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数.
已知:上述实验过程中反应关系为:CaO2~H2O2,5H2O2~2KMnO4
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是当看到加入1滴KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),30s不褪色,即达到滴定终点;
(6)由表中数据可知,该样品中CaO2含量为90%.若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果偏高(填“偏高”、“偏低”或“无影响”).
Ⅰ.某小组用含有少量氧化亚铁和氧化铁杂质的大理石制取过氧化钙的流程如下:

请回答下列问题:
(1)操作I的目的是调节溶液的pH,使铁元素完全沉淀,则试剂A最好选用c.
a.盐酸 b.硝酸 c.盐酸和过氧化氢 d.硫酸
(2)检验操作I中铁元素已沉淀完全的操作是取上层清液少许于试管中,滴加KSCN溶液,若溶液不变红,则铁元素已除净.
(3)滤液B主要成分的化学式是NH4Cl.
(4)反应Ⅱ是放热反应.保持H2O2物质的量一定,当H2O2浓度小于20%时,CaO2的产率随H2O2浓度的增大而增大;但浓度大于20%后,CaO2产率反而下降.试分析CaO2产率下降的可能原因是H2O2浓度高,反应速率快,反应放热使体系升温迅速,促使H2O2分解.
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量:
步骤1:准确称取0.3900g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入10mL蒸馏水和20mL磷酸(1:3),振荡使样品完全溶解;
步骤3:用0.1000mol•L-1 KMnO4标准溶液滴定至终点,记录数据;
步骤4:平行测定4次(数据记录见下表),计算试样中CaO2的质量分数.
| 实验 | 1 | 2 | 3 | 4 |
| V(KMnO4)/mL | 19.50 | 21.50 | 19.48 | 19.52 |
请回答下列问题:
(5)步骤3判断滴定达到终点的现象是当看到加入1滴KMnO4溶液,锥形瓶中溶液由无色变为浅红色(或粉红色、红色),30s不褪色,即达到滴定终点;
(6)由表中数据可知,该样品中CaO2含量为90%.若实验时刚洗净的滴定管未用KMnO4标准溶液润洗,则CaO2的质量分数测定结果偏高(填“偏高”、“偏低”或“无影响”).
 E; ③
E; ③ H;
H; I;⑤
I;⑤ G; ⑥
G; ⑥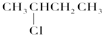 J.
J.