题目内容
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)NaH2PO2为 (填“正盐”或“酸式盐”),其溶液显 (填“弱酸性”“中性”或“弱碱性”).
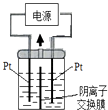
(3)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式: .
②分析产品室可得到H3PO2的原因: .
③早期采用“三室电渗析法”制备H3PO2:将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室.其缺点是产品中混有 杂质,该杂质产生的原因是 .
【答案】
(1)H3PO2?H2PO2﹣+H+
(2)正盐;弱碱性
(3)2H2O﹣4e﹣=O2↑+4H+;阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2;PO43﹣;H2PO2﹣或H3PO2被氧化
【解析】解:(1)H3PO2是一元中强酸,溶液中部分电离出氢离子,所以其电离方程式为H3PO2H2PO2﹣+H+ , 所以答案是:H3PO2H2PO2﹣+H+;
(2)根据H3PO2是一元中强酸,可以判断NaH2PO2为正盐,强碱弱酸盐溶液水解呈碱性,所以答案是:正盐;弱碱性;(3)①由于阳极中阴离子为硫酸根离子、氢氧根离子和H2PO2﹣ , 其中放电能力最强的是氢氧根离子,则阳极发生的电极反应为:2H2O﹣4e﹣=O2↑+4H+ , 所以答案是:2H2O﹣4e﹣=O2↑+4H+;②产品室可得到H3PO2的原因是因为:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2 ,
所以答案是:阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2﹣穿过阴膜扩散至产品室,二者反应生成H3PO2;③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是阳极产生的氧气会把H2PO2﹣或H3PO2氧化成PO43﹣ , 产品中混有PO43﹣ ,
所以答案是:PO43﹣;H2PO2﹣或H3PO2被氧化.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 阅读快车系列答案
阅读快车系列答案