题目内容
将3.9 g镁铝合金,投入到500 mL 2 mol/L的盐酸中,合金完全溶解,再加入5 mol/L的NaOH溶液,若要生成的沉淀最多,加入的这种NaOH溶液的体积是
| A.100 mL | B.150 mL | C.200 mL | D.250 mL |
C
解析试题分析:本题可用守恒法,镁铝合金与盐酸反应后生成的盐再和NaOH溶液,无论盐酸是否剩余,当生成的沉淀最多时,此时的溶液仅仅是NaCl的溶液,根据氯元素守恒及氯元素与钠元素的物质的量关系所求NaOH的物质的量也即HCl的物质的量1mol,所以加入的这种NaOH溶液的体积是1mol/5 mol/L=0.2L=200mL,答案选C。
考点:考查化学常用的计算方法

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
下列各组物质充分反应的气体产物中,只有一种气体的是 ( )
| A.木炭和浓硫酸共热 |
| B.铁粉与高温水蒸气反应 |
| C.足量的铜加入一定量的浓硝酸中 |
| D.Na2O2加入少量的氯化铵溶液中 |
不能用来鉴别Na2CO3和NaHCO3两种白色固体的实验操作是
| A.加热这两种固体物质,并将生成的气体通入澄清的石灰水中 |
| B.在这两种物质的溶液中加入CaCl2溶液 |
| C.在等量的两种固体中加入等体积等浓度的稀盐酸 |
| D.在这两种物质的溶液中加入少量澄清的石灰水 |
将Na2O2投入FeCl3溶液中,对观察到的现象描述准确的是
| A.生成白色沉淀 | B.生成红褐色沉淀 |
| C.有气泡产生 | D.生成红褐色沉淀、有气泡产生 |
利用下列实验装置,不能完成实验目的的是( )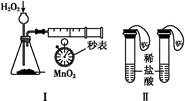
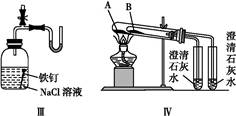
| A.利用装置Ⅰ进行H2O2分解反应速率的定量测定 |
| B.利用装置Ⅱ进行碳酸氢钠与碳酸钠的检验 |
| C.利用装置Ⅲ证明铁生锈时空气参与反应 |
| D.利用装置Ⅳ进行碳酸氢钠与碳酸钠稳定性强弱比较 |
下列除杂所用的方法、试剂或发生的反应错误的是( )。
| A.除去FeCl2中的CuCl2:Fe+Cu2+=Fe2++Cu |
| B.除去Fe中的少量Al,可将固体加入到足量的NaOH溶液中,过滤 |
| C.除去FeCl2中的FeCl3:2Fe3++Fe=3Fe2+ |
| D.除去Fe2O3中的Fe(OH)3,可向混合物中加入足量的盐酸 |
下列类推正确的是( )。
| A.CaCO3与稀硝酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2 |
| B.铜在氯气中剧烈燃烧生成二价铜,铜也能在硫蒸气中剧烈燃烧生成二价铜 |
| C.锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置 换反应 |
| D.钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气 |
下列有关金属及其化合物的说法正确的是( )
| A.由于铝在常温下不能与氧气反应,所以铝制品具有一定的抗腐蚀性能,是一种应用广泛的金属材料 |
| B.往FeCl3溶液中滴入KI-淀粉溶液,溶液变蓝色 |
| C.向紫色石蕊试液中加入过量的Na2O2粉末,振荡,溶液变为蓝色并有气泡产生 |
| D.装修门窗使用的铝合金材料的硬度比铝小,熔点比铝低 |
