题目内容
13.常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的c(OH-)和水电离出的c(OH-)之比为( )| A. | 1:1 | B. | 108:1 | C. | 5×109:1 | D. | 1010:1 |
分析 NaOH是强电解质,在水溶液中完全电离,水也电离出OH-,但浓度较小,所以溶液中c(OH-)大多数来自于NaOH电离,水电离出的c(OH-)可以忽略,所以该溶液中NaOH电离出c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$;
碱溶液中c(H+)全部来自于水电离,所以水电离出的c(OH-)=c(H+),据此分析解答.
解答 解:NaOH是强电解质,在水溶液中完全电离,水也电离出OH-,但浓度较小,所以溶液中c(OH-)大多数来自于NaOH电离,水电离出的c(OH-)可以忽略,所以该溶液中NaOH电离出c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L;
碱溶液中c(H+)全部来自于水电离,所以水电离出的c(OH-)=c(H+)=10-11 mol/L,
则由NaOH电离出的c(OH-)和水电离出的c(OH-)之比=10-3mol/L:10-11 mol/L=108:1,
故选B.
点评 本题考查pH有关计算,为高频考点,明确溶液中水电离出c(OH-)、NaOH电离出c(OH-)计算方法是解本题关键,难点是水电离出c(OH-)计算方法,题目难度不大.

练习册系列答案
相关题目
3.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3 (s)+3H2 (g)$\stackrel{高温}{?}$W (s)+3H2O (g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{3}(H{\;}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O;580℃时,固体物质的主要成分为W2O5、WO2;假设WO3完全转化为W,则三个阶段消耗H2物质的量之比为1:1:4.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{c{\;}^{3}(H{\;}_{2}O)}{c{\;}^{3}(H{\;}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为吸热反应(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如下表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
4.下列说法中,正确的是( )
| A. | 4p2表示4p能级有2个轨道 | |
| B. | 水、氨气、甲烷的键角依次减小 | |
| C. | 原子序数为14、15、35的元素位于周期表的P区 | |
| D. | 分子中键长越短、键能越大,则分子越稳定 |
1.下列反应的离子方程式中正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 氢氧化钡溶液与稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 澄清石灰水与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+=Ca2++CO2↑+H2O |
18.下列反应中,不属于盐类水解反应的是( )
| A. | Al3++3HCO${\;}_{3}^{-}$=Al(OH)3↓+3CO2↑ | B. | Al3++3H2O?Al(OH)3+3H+ | ||
| C. | NH4++2H2O?NH3•H2O+H3O+ | D. | HCO${\;}_{3}^{-}$+H2O?H3O++CO${\;}_{3}^{2-}$ |
5.(一)化学实验有助于理解化学知识,形成化学观念.在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验.
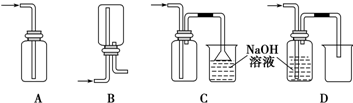
(1)下列收集Cl2的正确装置是C.
(2)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是Cl2;HClO.
(3)设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,逐渐滴加NaBr溶液,振荡静置,液体分层,下层溶液呈橙红色.
(二)某学生对SO2与漂粉精(漂白粉)的反应进行实验探究:
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(2)用离子方程式解释漂粉精溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性;漂白性.
(4)将A瓶中混合物过滤、洗涤,得到沉淀X,向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4.

(1)下列收集Cl2的正确装置是C.
(2)将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是Cl2;HClO.
(3)设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,逐渐滴加NaBr溶液,振荡静置,液体分层,下层溶液呈橙红色.
(二)某学生对SO2与漂粉精(漂白粉)的反应进行实验探究:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
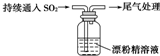 A | ⅰ.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)用离子方程式解释漂粉精溶液使pH试纸变蓝的原因ClO-+H2O?HClO+OH-.
(3)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性;漂白性.
(4)将A瓶中混合物过滤、洗涤,得到沉淀X,向沉淀X中加入稀HCl,无明显变化.取上层清液,加入BaCl2溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4.
2.下列说法正确的是( )
| A. | 食用植物油是人体的营养物质 | |
| B. | 分馏、干馏是物理变化,裂化、裂解是化学变化 | |
| C. | 淀粉、蛋白质、葡萄糖都是高分子化合物 | |
| D. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 |
3.下列试剂中,标签上应同时标注下列标志的是( )


| A. | 乙醇 | B. | 盐酸 | C. | NaOH | D. | HNO3 |
 .
.