题目内容
n〔H2(Mg、Al)〕="1.736" L÷22.4 L·mol-1="0.077" 5 mol
n〔H2(Al)〕="(2.550" g÷102 g·mol-1)×3="0.075" 0 mol?
n〔H2(Mg)〕="0.077" 5 mol-0.075 0 mol="0.002" 50 mol?
w(Mg)="(0.002" 50 mol×24 g·mol-1)÷1.500 g="0.040" 0=4.00%
n〔H2(Al)〕="(2.550" g÷102 g·mol-1)×3="0.075" 0 mol?
n〔H2(Mg)〕="0.077" 5 mol-0.075 0 mol="0.002" 50 mol?
w(Mg)="(0.002" 50 mol×24 g·mol-1)÷1.500 g="0.040" 0=4.00%
本题考查了金属及合金的有关计算。根据题意分析先计算放出H2的总量。由Al2O3的质量可计算出Al的物质的量,从而算出Al与盐酸反应生成H2的量。再由放出H2的总量计算出Mg与盐酸反应放出H2的量,最后算出Mg的量,即质量分数。

练习册系列答案
相关题目
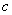 (Mg2+)为0.2mol?L-1,
(Mg2+)为0.2mol?L-1,