题目内容
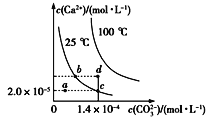
【题目】298K(25℃)下,在NaHS溶液中,各离子的浓度随NaHS溶液浓度的变化关系如图所示,下列叙述正确的是
已知:(1)在科学计数法中,为了使公式简便,可以用带“E”的格式表示,例如:1E-4=1×10-4。
(2)298K(25℃)下H2S的Ka1=9.10×10-8,Ka2=1.10×10-12。

A. 0.10mol/LNaHS溶液:c(Na+)>c(HS-)>c(OH-)>c(S2-)
B. Na2S溶液中:c(OH-)-c(H+)=c(H2S)+c(HS-)
C. 当c(OH-)=c(S2-)时,c(HS-)=9.09×10-3
D. 室温下用NaOH溶液滴定NaHS溶液,滴定终点刚好形成0.1mol/LNa2S溶液,该过程可选择酚酞作指示剂
【答案】C
【解析】
A.根据电荷守恒可知,溶液中存在阴离子为S2-、HS-、OH-,阳离子为H+、Na+,阳离子所带电荷总数等于阴离子所带电荷总数;
B.硫化钠溶液中水电离的氢离子与氢氧根离子相等,即质子守恒,根据质子守恒进行判断;
C、当c(OH-)=c(S2-)时,图象分析可知为0.01mol/LNa2S溶液,根据Ka2=![]() 进行计算;
进行计算;
D. 滴定终点刚好形成0.1mol/LNa2S溶液,则滴定前NaHS溶液浓度约为0.05mol/L,滴定前后溶液均为碱性,不能选择酚酞作指示剂。
A.根据电荷守恒可知,c(H+)+c(Na+)=2c(S2-)+c(HS-)+c(OH-),选项A错误;
B.根据硫化钠溶液中的质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),选项B错误;
C、当c(OH-)=c(S2-)时,图象分析可知为0.01mol/LNa2S溶液,根据Ka2=![]() 可得c(HS-)=
可得c(HS-)=![]() =
= =
=![]() =9.09×10-3,选项C正确;
=9.09×10-3,选项C正确;
D. 滴定终点刚好形成0.1mol/LNa2S溶液,则滴定前NaHS溶液浓度约为0.05mol/L,滴定前后溶液均为碱性,不能选择酚酞作指示剂,选项D错误。
答案选C。

【题目】I.明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:

已知生成氢氧化物沉淀的pH如下表所示:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀 | 3.4 | 6.3 | 1.5 |
完全沉淀 | 4.7 | 8.3 | 2.8 |
回答下列问题:
(1)明矾净水的原理是______________________________(用离子方程式表示)。
(2)操作Ⅱ是_______________、_________________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的方法______________________________ (只用一种试剂)。
(4)在滤液A中加入高锰酸钾发生反应的离子方程式为:__________。
(5)调节pH=3的目的是_______________________ ,滤渣2含有的物质是______。
II.(6)取一定量含有Pb2+、Cu2+的工业废水,向其中滴加Na2S溶液,当PbS开始沉淀时,溶液中c(Pb2+)/c(Cu2+) =_________ (保留三位有效数字)。[已知Ksp(PbS)=3.4×10-28,
Ksp(CuS)=1.3×10-36]
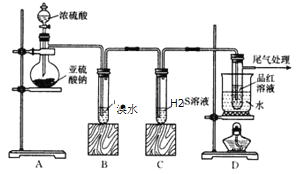
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下:![]() +Cl2
+Cl2![]()
![]() +HCl
+HCl 
已知:氯苯为无色液体,沸点132.2 ℃。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是______。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60 ℃为宜,温度过高会生成二氯苯。
①对C加热的方法是________(填字母)。
a.酒精灯加热 b.油浴加热 c.水浴加热
②D出口的气体成分有HCl、________和________。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:_____________、__________(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是________。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg·t-1) | 13 | 24.9 | 51.3 | 89.2 |
则1 t苯可制得成品为________t(只要求列式)。