题目内容
在25℃时,用石墨电极电解2.0L,2.5mol/LCuSO4溶液.5min后,在一个石墨电极上有6.4g Cu生成.试回答:
(1)转移电子的物质的量,得到O2的体积(标准状况),溶液的pH?
(2)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?电解液的pH是否变化?(相对原子质量 Cu:64)
(1)转移电子的物质的量,得到O2的体积(标准状况),溶液的pH?
(2)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?电解液的pH是否变化?(相对原子质量 Cu:64)
分析:(1)根据n=
计算6.4gCu的物质的量,阴极发生2Cu2++4e-=2Cu,据此计算转移电子物质的量;
阳极发生反应4OH--4e-=2H2O+O2↑,根据电子转移守恒计算V(O2);
溶液中n(H+)=n放电(OH-),根据c=
计算c(H+),再根据pH=-lgc(H+)计算;
(2)用等质量的两块铜片代替石墨作电极,电极反应为:阳极:Cu-2e-=Cu2+,阴极:Cu2++2e-=Cu,根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,据此计算;
反应溶液中c(H+)不变,pH不变.
| m |
| M |
阳极发生反应4OH--4e-=2H2O+O2↑,根据电子转移守恒计算V(O2);
溶液中n(H+)=n放电(OH-),根据c=
| n |
| V |
(2)用等质量的两块铜片代替石墨作电极,电极反应为:阳极:Cu-2e-=Cu2+,阴极:Cu2++2e-=Cu,根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,据此计算;
反应溶液中c(H+)不变,pH不变.
解答:解:(1)6.4gCu的物质的量=
=0.1mol,
设转移电子的物质的量为x,则:
2Cu2++4e-=2Cu
2 4 2
x 0.1mol
所以4:x=2:0.1mol,解得x=0.2mol
生成氧气的体积为V,则:
根据电子守恒:4OH--4e-=2H2O+O2↑
4mol 4mol 22.4L
n(OH-) 0.2mol V
所以,4mol:0.2mol=22.4L:V,解得v=1.12L.n(OH-)=0.2mol,
溶液中n(H+)=n放电(OH-),所以c(H+)=
=0.1mol/L,故pH=-lgc(H+)=1,
答:转移电子的物质的量为0.2mol;得到O2的体积(标准状况)为1.12L;溶液的pH=1.
(2)用等质量的两块铜片代替石墨作电极,电极反应为:阳极:Cu-2e-=Cu2+ 阴极:Cu2++2e-=Cu 根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,故电解后两铜片的质量相差为:6.4g+6.4g=12.8g,溶液中c(H+)不变,pH不变,
答:电解后两铜片的质量相差12.8g;电解液的pH不变化.
| 6.4g |
| 64g/mol |
设转移电子的物质的量为x,则:
2Cu2++4e-=2Cu
2 4 2
x 0.1mol
所以4:x=2:0.1mol,解得x=0.2mol
生成氧气的体积为V,则:
根据电子守恒:4OH--4e-=2H2O+O2↑
4mol 4mol 22.4L
n(OH-) 0.2mol V
所以,4mol:0.2mol=22.4L:V,解得v=1.12L.n(OH-)=0.2mol,
溶液中n(H+)=n放电(OH-),所以c(H+)=
| 0.2mol |
| 2L |
答:转移电子的物质的量为0.2mol;得到O2的体积(标准状况)为1.12L;溶液的pH=1.
(2)用等质量的两块铜片代替石墨作电极,电极反应为:阳极:Cu-2e-=Cu2+ 阴极:Cu2++2e-=Cu 根据转移电子守恒,阴极析出铜的质量和阳极溶解铜的质量相等,都是6.4g,故电解后两铜片的质量相差为:6.4g+6.4g=12.8g,溶液中c(H+)不变,pH不变,
答:电解后两铜片的质量相差12.8g;电解液的pH不变化.
点评:本题考查电解原理及有关计算,难度不大,注意电子转移守恒的利用,(2)中实质是电镀.

练习册系列答案
相关题目
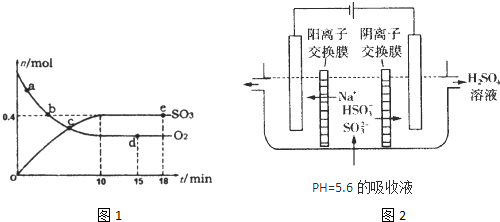
 Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。