题目内容
4.物质的性质决定用途,以下物质的用途只利用了物质的物理性质的有( )| A. | 二氧化碳用于灭火 | B. | 氧气供给呼吸 | ||
| C. | 金刚石用作钻探机的钻头 | D. | 用镁制作照明弹 |
分析 物质的化学性质是指在化学变化中表现出来的性质,物质的物理性质是指不需要通过化学变化表现出来的性质,据此进行分析判断.
解答 解:A.二氧化碳用于灭火,既利用了不燃烧、不支持燃烧的化学性质,又利用了密度比空气大的物理性质,故A错误;
B.呼吸是吸入氧气呼出二氧化碳,属于化学变化,所以氧气用于供给呼吸,利用了化学性质,故B错误;
C.金刚石用作钻探机的钻头,是利用金刚石硬度大的物理性质,故C正确;
D.用镁制作照明弹,是利用了镁燃烧发出耀眼白光的性质,需要通过化学变化才表现出来,故D错误;
故选:C.
点评 本题考查了物理性质、化学性质的用途,联系物理变化、化学变化来理解物理性质和化学性质是解题关键,题目难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
14.粗盐的提纯使用的主要仪器有:①漏斗 ②烧杯 ③蒸发皿 ④酒精灯 ⑤量筒 ⑥试管夹 ⑦玻璃棒⑧集气瓶 ⑨天平( )
| A. | ①②③④⑦ | B. | .①②③④⑤ | C. | .①②③⑥⑧ | D. | .③④⑦⑧⑨ |
15.将充有n mLNO和m mL NO2气体的试管倒立于盛水的水槽中,然后通入n mL O2.气体体积均在同温同压下测定,且m>n,则充分反应后,试管中气体在同温同压下的体积为( )
| A. | $\frac{m-n}{3}$mL | B. | $\frac{n-m}{3{M}_{1}}$ | C. | $\frac{4m-1}{13}$mL | D. | $\frac{3}{m-n}$mL |
12.常温下某溶液中由水电离的c(H+)=1×10-10mol/L,该溶液中溶质不可能是( )
| A. | NaHSO4 | B. | Al2(SO4)3 | C. | NaOH | D. | HCl |
19.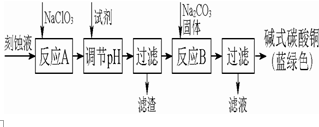 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
(1)氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;滤渣的主要成分是Fe(OH)3(写化学式).
(2)反应A后调节溶液的pH范围应为3.2-4.2.可以选择的试剂是bd(填序号).
a.氨水 b.氧化铜 c.氧化镁 d.碳酸铜 e..稀氢氧化钠
(3)反应B的温度若过高,则所得蓝绿色产品中可能会出现的杂质是CuO.(写化学式)
(4)洗涤过滤得到的产品时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓.
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑.
 碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:
碱式碳酸铜是一种用途广泛的化工原料.工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如图图所示.Cu2+、Fe2+、Fe3+生成沉淀的pH如表格所示:| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(2)反应A后调节溶液的pH范围应为3.2-4.2.可以选择的试剂是bd(填序号).
a.氨水 b.氧化铜 c.氧化镁 d.碳酸铜 e..稀氢氧化钠
(3)反应B的温度若过高,则所得蓝绿色产品中可能会出现的杂质是CuO.(写化学式)
(4)洗涤过滤得到的产品时,如何判断产品已经洗净?取最后一次洗涤液,加入硝酸银和稀硝酸,无沉淀生成则表明已洗涤干净.
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀.
①若沉淀只有CuCO3,则相应的离子方程式为Cu2++CO32-=CuCO3↓.
②若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑.
16.下列实验方案中,可行的是( )
| A. | 用加入适量NaCl溶液的方法除去Cu(NO3)2溶液中的AgNO3杂质 | |
| B. | 用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 | |
| C. | 分离FeCl3、KCl、BaSO4的固体混合物,应采用的一组试剂是:水、氢氧化钠、盐酸 | |
| D. | 先后添加石蕊试液、BaCl2溶液,将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开. |
13.配制一定物质的量浓度的溶液不需要用到的仪器是( )
| A. |  | B. |  | C. |  | D. |  |