题目内容
【题目】下列有关化学键的类型说法正确的是( )
A. HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
B. 非金属元素组成的化合物中只含共价键
C. H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物
D. NaHCO3和HCOONa都只含离子键
【答案】C
【解析】
A.氯化氢是共价化合物,故A错误;
B. 非金属元素组成的化合物中有的含有离子键,如铵盐,故B错误;
C.H与O、H与N均可形成既含极性共价键又含非极性共价键的化合物,比如H2O2、N2H4,故C正确;
D. NaHCO3和HCOONa中既含离子键也含共价键,故D错误;
答案:C

【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.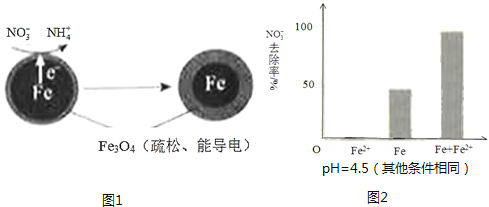
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
【题目】氯苯是重要的有机化工产品,是染料、医药、有机合成的中间体,工业上常用“间歇法”制取。反应原理、实验装置图(加热装置都已略去)如下: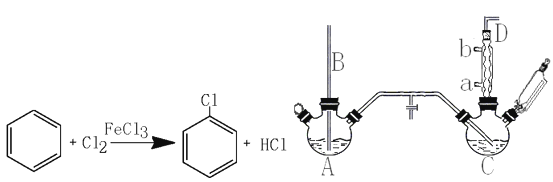
已知:氯苯为无色液体,沸点132.2℃,常温下不与氢氧化钠溶液反应。
回答下列问题:
(1)A反应器是利用实验室法制取氯气,中空玻璃管B的作用是。冷凝管中冷水应从(填“a”或“b”)处通入。
(2)把干燥的氯气通入装有干燥苯的反应器C中(内有相当于苯量1%的铁屑作催化剂),加热维持反应温度在40~60℃为宜,温度过高会生成二氯苯。
①对C加热的方法是(填序号)。
a.酒精灯加热 b.酒精喷灯加热 c.水浴加热
②D出口的气体成分有HCl、和。
(3)C反应器反应完成后,工业上要进行水洗、碱洗及食盐干燥,才能蒸馏。碱洗之前要水洗的目的是洗去部分无机物,同时减少碱的用量,节约成本。写出用10%氢氧化钠碱洗时可能发生的化学反应方程式:;(写两个即可)。
(4)上述装置图中A、C反应器之间,需要增添一个U形管,其内置物质是。
(5)工业生产中苯的流失情况如下:
项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
则1t苯可制得成品为t(只要求列式)。