��Ŀ����
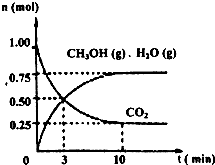
��18����ҵ����CO����ȼ�ϼ״���һ�������·�����Ӧ��CO(g)+2H2(g)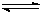 CH3OH(g)��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��
CH3OH(g)��ͼ1��ʾ��Ӧ�������ı仯��ͼ2��ʾһ���¶��£������Ϊ2L���ܱ������м���4mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��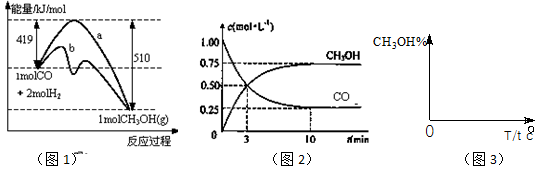
��ش��������⣺
��1���ڡ�ͼ1���У����� ���a��b����ʾʹ���˴������÷�Ӧ���� ������ȡ����ȣ���Ӧ��
��2������˵����ȷ����
A����ʼ�����COΪ2mol
B������COŨ�ȣ�CO��ת��������
C��������ѹǿ�㶨ʱ����Ӧ�Ѵ�ƽ��״̬
D�������¶Ⱥ��ܱ������ݻ��� �䣬�ٳ���1molCO��2molH2���ٴδﵽƽ��ʱ
�䣬�ٳ���1molCO��2molH2���ٴδﵽƽ��ʱ
n(CH3OH)/n(CO)���С
��3���� ��Ӧ��ʼ������ƽ�⣬ v(H2)=________����֪����һ���¶��£���һ�����淴Ӧ�ﵽ��ѧƽ��ʱ��������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ��һ������������������Ǹ÷�Ӧ�Ļ�ѧƽ�ⳣ������ô�ڸ��¶���CO(g)+2H2(g)
��Ӧ��ʼ������ƽ�⣬ v(H2)=________����֪����һ���¶��£���һ�����淴Ӧ�ﵽ��ѧƽ��ʱ��������Ũ����֮���뷴Ӧ��Ũ����֮���ı�ֵ��һ������������������Ǹ÷�Ӧ�Ļ�ѧƽ�ⳣ������ô�ڸ��¶���CO(g)+2H2(g) 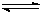 CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ_______________�������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ��____
CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ_______________�������������������䣬����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ��____ �����������С�����䡱����
�����������С�����䡱����
��4�����ڡ�ͼ3���л���ƽ��ʱ�״��ٷֺ����������꣩���¶ȣ������꣩�仯�����ߣ�Ҫ��ѹǿ��ͬ��2�����ߣ��������ϱ��P1��P2����P1<P2����
(5) ��һ��״����ӽ���Ĥȼ�ϵ�أ��轫�״�����ת��Ϊ���������ַ�Ӧԭ����
A��CH3OH(g)��H2O(g)��CO2(g)��3H2(g) ��H����49.0kJ/mol
B��CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(g) ��H����192.9kJ/mol
��֪H2O(l)= H2O(g) ��H����44 kJ/mol����д��32g��CH3OH(g)��ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ ��
��1��b ����
��2����2�֣�AC��ѡ1������ȷ����1�֣���1��0�֣�
��3����6�֣�0.15mol��L-1��min-1��2�֣� 12 L2��mol-2��2�֣���λ���۷֣���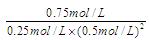 ����С(2��)
����С(2��)
��4��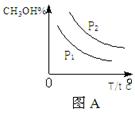 (3��)
(3��)
(5) CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(l) ��H����280.9kJ/mol (3��)
����

 ��У����ϵ�д�
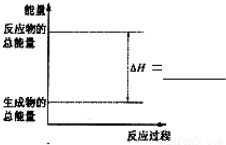
��У����ϵ�д���ͨ�����ǰѲ�1molij��ѧ�������յ��������ɸû�ѧ���ļ��ܣ����ܵĴ�С���Ժ�����ѧ����ǿ����Ҳ�����ڹ��㻯ѧ��Ӧ�ķ�Ӧ�ȣ���H������ѧ��Ӧ�ġ�H���ڷ�Ӧ�ж��Ѿɻ�ѧ���ļ���֮���뷴Ӧ���γ��»�ѧ���ļ���֮�͵IJ?
| ��ѧ�� | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | O=O |
| ����/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 498 |
��1���Ƚ������������ʵ��۵�ߵͣ��������������SiC______Si��SiCl4______SiO2��
��2����ҵ���øߴ����ͨ�����з�Ӧ��ȡ��SiCl4��g��+2H2��g��
 Si��s��+4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�H=______
Si��s��+4HCl��g�����÷�Ӧ�ķ�Ӧ�ȡ�H=______kJ?mol-1��
��3�������ͼ��ʾ����Si��O2����ȫȼ������SiO2����������仯ͼ����������
��ijʵ��С���������ʵ��
A �ֱ�����250mL 1.0mol/L�������250mL 1.1mol/L����������Һ��
B ÿ�ηֱ�ȡ���������Ƶ�����50mL������������50mL�����кͷ�Ӧ����ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȣ��Իش��������⣺?
��1��Ϊ����A��ʵ��ʱ����ʵ������������ƽ��ҩ�ס�С�ձ�������������Ͳ��
250mL����ƿ��2��������ȱ�ٵ�������______ ����B��ʵ��ʱ����ʵ���������ձ���С�ձ�����Ͳ��2������С�ձ������ϰ塢��ֽ�����ɻ�ȱ�ٵ�ʵ��������______��
��2����ʵ������У���������¶ȼ��ϵ�����ˮ��ϴ�ɾ�ֱ�Ӳ���NaOH��Һ���¶ȣ����õġ�H______���ƫ����ƫС������Ӱ�족����
��3����ʵ��С����������ʵ�飬ÿ��ȡ��Һ��50mL������¼����ԭʼ���ݣ�?
| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | �²t2-t1�� /�� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 31.8 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
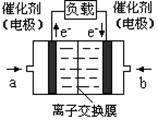
 2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���
2009��12��7��һ18���ڵ������籾�����ٿ������Ϲ�������飬��δ��Ӧ������仯��ȫ���ж�ǩ���µ�Э�飮����ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2��������ȫ������ձ����ӣ�Ϊ��С������CO2�Ի�����Ӱ�죬һ����������������������ŷ�������һ�����ѧ�Ҽ�ǿ�˶�CO2�������õ��о���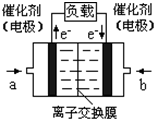 ��ͼ����a��ͨ�����
��ͼ����a��ͨ�����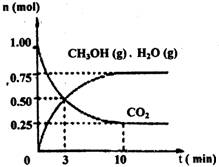
 HCO3- +H+�ĵ���ƽ�ⳣ��K= ������֪��10 -5��6=2��5��l0-6����
HCO3- +H+�ĵ���ƽ�ⳣ��K= ������֪��10 -5��6=2��5��l0-6����