题目内容
本题由两部分组成Ⅰ通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.?
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | O=O |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 498 |
(1)比较下列两组物质的熔点高低(填“>”或“<”):SiC______Si;SiCl4______SiO2.
(2)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
 Si(s)+4HCl(g),该反应的反应热△H=______
Si(s)+4HCl(g),该反应的反应热△H=______kJ?mol-1.
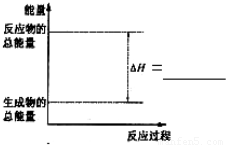
(3)请把如图表示固体Si在O2中完全燃烧生成SiO2固体的能量变化图补充完整.
Ⅱ某实验小组设计下列实验
A 分别配制250mL 1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液.
B 每次分别取用上述配制的盐酸50mL跟和氢氧化钠50mL进行中和反应,并通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:?
(1)为进行A步实验时,有实验仪器托盘天平、药匙、小烧杯、玻璃棒、量筒、
250mL容量瓶(2个),还缺少的仪器有______ 进行B步实验时,有实验仪器大烧杯、小烧杯、量筒(2个)、小烧杯、塑料板、废纸条若干还缺少的实验仪器有______.
(2)在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H______(填“偏大”、“偏小”或“无影响”);
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1) /℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 31.8 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
【答案】分析:Ⅰ(1)由提供的键能数据可以看出,键能大小关系为:Si-O>Si-C>Si-Si;
(2)反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差;
(3)固体Si在O2中完全燃烧生成SiO2固体是放热反应;
Ⅱ(1)根据配制溶液和中和热需要的仪器解答;
(2)中和反应是放热反应;
(3)在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热,根据△H=-Cm(t2-t1)解题;
解答:解:Ⅰ(1)由提供的键能数据可以看出,键能大小关系为:Si-O>Si-C>Si-Si,而SiCl4为分子晶体,键能大小与熔沸点无关,所以,熔沸点高低是:SiC>Si;SiCl4>SiO2,故答案为:>;<;
(2)计算方法的依据是“反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差”,值得注意的是:尽管在化学方程式中硅单质用Si表示,但其分摊到的化学键是两个Si-Si键.所以,△H=4×360 kJ?mol-1+2×436kJ?mol-1-2×176 kJ?mol-1-4×431kJ?mol-1=236kJ?mol-1,故答案为:+236;
(3)固体Si在O2中完全燃烧生成SiO2固体是放热反应,△H=2×176kJ?mol-1+498kJ?mol-1-4×460kJ?mol-1=-990kJ?mol-1,故答案为: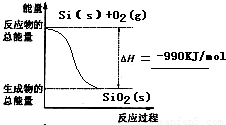 ;
;
Ⅱ?(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取浓盐酸(或用托盘天平称取氢氧化钠),在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、盘天平、250mL容量瓶;中和热需要仪器:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒,故答案为:胶头滴管;环形玻璃搅拌棒和温度计;
(2)中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,使测得的中和热偏高,
故答案为:偏大;
(3)温差(t2-t1)应取三次实验的平均值6.7℃来计算.△H=-Cm(t2-t1)=-4.18×10-3kJ/(g?℃)×100g×6.7℃
=2.8006kJ,反应取1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液各50mL进行中和反应,生成的水是0.05mol,故若生成1mol,△H=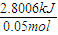 =-56.01 kJ/mol,
=-56.01 kJ/mol,
故答案为:HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01 kJ/mol;
点评:本题考查化学反应中能量转化的原因,中和热的测定,难度较大,在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.
(2)反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差;
(3)固体Si在O2中完全燃烧生成SiO2固体是放热反应;
Ⅱ(1)根据配制溶液和中和热需要的仪器解答;
(2)中和反应是放热反应;
(3)在稀溶液中,酸跟碱发生中和反应生成1 mol水时的反应热叫做中和热,根据△H=-Cm(t2-t1)解题;
解答:解:Ⅰ(1)由提供的键能数据可以看出,键能大小关系为:Si-O>Si-C>Si-Si,而SiCl4为分子晶体,键能大小与熔沸点无关,所以,熔沸点高低是:SiC>Si;SiCl4>SiO2,故答案为:>;<;
(2)计算方法的依据是“反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差”,值得注意的是:尽管在化学方程式中硅单质用Si表示,但其分摊到的化学键是两个Si-Si键.所以,△H=4×360 kJ?mol-1+2×436kJ?mol-1-2×176 kJ?mol-1-4×431kJ?mol-1=236kJ?mol-1,故答案为:+236;
(3)固体Si在O2中完全燃烧生成SiO2固体是放热反应,△H=2×176kJ?mol-1+498kJ?mol-1-4×460kJ?mol-1=-990kJ?mol-1,故答案为:
 ;
;Ⅱ?(1)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取浓盐酸(或用托盘天平称取氢氧化钠),在烧杯中稀释,用玻璃棒搅拌,冷却至室温后转移到250mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切,盖好瓶塞颠倒摇匀.所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、盘天平、250mL容量瓶;中和热需要仪器:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒,故答案为:胶头滴管;环形玻璃搅拌棒和温度计;
(2)中和反应是放热反应,温度计上的酸与NaOH溶液反应放热,使温度计读数升高,使测得的中和热偏高,
故答案为:偏大;
(3)温差(t2-t1)应取三次实验的平均值6.7℃来计算.△H=-Cm(t2-t1)=-4.18×10-3kJ/(g?℃)×100g×6.7℃
=2.8006kJ,反应取1.0mol/L盐酸跟和250mL 1.1mol/L氢氧化钠溶液各50mL进行中和反应,生成的水是0.05mol,故若生成1mol,△H=
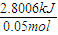 =-56.01 kJ/mol,
=-56.01 kJ/mol,故答案为:HCl(aq)+NaOH(aq)=H2O(l)+NaCl(aq);△H=-56.01 kJ/mol;
点评:本题考查化学反应中能量转化的原因,中和热的测定,难度较大,在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 本题由两部分组成
本题由两部分组成
