题目内容
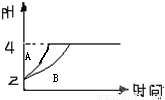
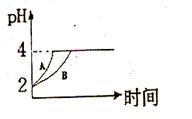
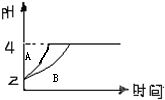 (1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是B
B
(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1<
<
m2(选填“<”、“=”、“>”)
(2)pH=3盐酸和pH=11氨水等体积混合后溶液呈
碱
碱
性(选填“酸”、“中”或“碱”),溶液中c(NH4+)>
>
c(Cl-)(选填“>”“=”“<”).分析:(1)从醋酸是弱电解质的角度分析,醋酸与Zn反应同时,电离出H+,pH变化较缓慢;
(2)据两种溶液中H+和OH-的关系以及氨水为弱电解质的性质,判断反应后酸碱的过量,进而判断反应后溶液的酸碱性.
(2)据两种溶液中H+和OH-的关系以及氨水为弱电解质的性质,判断反应后酸碱的过量,进而判断反应后溶液的酸碱性.
解答:解:(1)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,盐酸中氢离子浓度逐渐减小,但醋酸中存在电离平衡,氢离子和锌反应时促进醋酸电离,补充反应的氢离子,所以醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,溶液中c(H+)<c(OH-),溶液呈电中性,则c(H+)+C(NH4+)=c(OH-)+C(Cl-),所以C(NH4+)>C(Cl-),
故答案为:碱性,>.
故答案为:B;<;
(2)pH=3的盐酸中c(H+)=10-3mol/L,pH=11的氨水中c(OH-)=10-3mol/L,两种溶液H+与OH-离子浓度相等,但由于氨水为弱电解质,不能完全电离,则氨水浓度大于盐酸浓度,反应后氨水过量,溶液呈碱性,溶液中c(H+)<c(OH-),溶液呈电中性,则c(H+)+C(NH4+)=c(OH-)+C(Cl-),所以C(NH4+)>C(Cl-),
故答案为:碱性,>.
点评:本题考查了弱电解质的电离,难度不大,(2)题注意溶液H+与OH-离子浓度相等时,氨水过量.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
 A. 增加C的物质的量 B. 加压
A. 增加C的物质的量 B. 加压