题目内容
选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g) ![]() 4C (g) △H >0 达到平衡时,c(A) =2 mol·L-1,c ( B) = 7 mol·L-1,c ( C) = 4 mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) =2 mol·L-1,c ( B) = 7 mol·L-1,c ( C) = 4 mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
 A. 增加C的物质的量 B. 加压
A. 增加C的物质的量 B. 加压
C. 升温 D. 使用催化剂
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则
m1 m2 ( 选填“<”、“=”、“>”)
(3) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 难溶电解质在水溶液中也存在溶解平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH)2(s)![]() Cu2+ (aq) + 2OH - ( aq),Ksp = c (Cu2+ ) c 2(OH - ) = 2×10 -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) =0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4 溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp = c (Cu2+ ) c 2(OH - ) = 2×10 -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) =0.02 mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4 溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案用来评判甲乙两位同学的观点是否正确(包括操作、现象和结论) 。
(1)[3 mol·L-1,9 mol·L-1】] C
(2)B <
(3) C(CH3OH)/ [C( CO)*C 2(H2)] 减小
(4)5 7
(5) 碱 向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪色说明乙正确(其他试剂合理也给分)

 4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。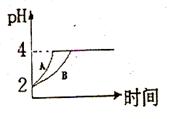
 4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。