题目内容
【题目】锌与不同浓度的硫酸反应时,硫酸的还原产物为SO2或H2。为验证这一事实,某同学用下图装置在室温下进行实验。
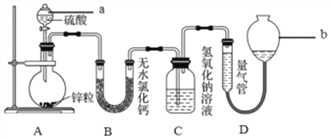
请回答下列问题:
(1)仪器a的名称是_________,若在圆底烧瓶中放入1.0g锌,选用量气管的适宜规格是(按标况计算)_____ (填字母序号)。
A.200mL B.300mL C.400mL D.500mL
(2)按上图连接好装置后,检查A装置气密性的操作是____,为使仪器a中的硫酸顺利加入圆底烧瓶,应_____并旋转活塞。
(3)实验发现:1.0g锌完全溶解后氢氧化钠洗气瓶增重0.8g,写出圆底烧瓶中发生反应的化学方程式:_________________。
(4)若ag锌与cmol/L的硫酸VL充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中, ![]() =______(用含字母的代数式表示), 若撤走B装置,
=______(用含字母的代数式表示), 若撤走B装置, ![]() 的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
的数值将______(填“偏大”、“偏小”或“无影响”),其原因是________________。
(5)为准确测量气体体积,量气管在读数时应注意的操作有_______。
【答案】 分液漏斗 C 关闭分液漏斗(或 a) 活塞,用热毛巾(或双手) 捂热圆底烧瓶, 一段时间后 C中浸入液体中的导气管末端有气泡冒出, 移开热毛巾(或双手)后 C 中导气管中上升一段稳定的水柱(其它合理答案也可) 打开分液漏斗(或 a)的瓶塞(或玻璃塞)(或使瓶塞上的凹槽对准分液漏斗颈部的小孔) Zn + 2H2SO4(浓) ===ZnSO4 + SO2↑+ H2O 、Zn + H2SO4 === ZnSO4 + H2↑ ![]() 偏小 A 中产生的水蒸气进入装置 C 中使得计算的 n(SO2)偏大 读数前移动 b 使量气管左右液面相平; ②视线与量气管凹液面最低点在同一水平面 ③待装置冷却至室温读数
偏小 A 中产生的水蒸气进入装置 C 中使得计算的 n(SO2)偏大 读数前移动 b 使量气管左右液面相平; ②视线与量气管凹液面最低点在同一水平面 ③待装置冷却至室温读数
【解析】(1)由装置图可得,仪器a是分液漏斗;C中盛有氢氧化钠溶液,则量气管D测量的是氢气的体积,根据反应Zn+H2SO4=ZnSO4+H2↑,n(H2)=n(Zn)=1.0g÷65g/mol=![]() mol,则标准状况下V(H2)=
mol,则标准状况下V(H2)= ![]() mol×22.4L/mol=
mol×22.4L/mol=![]() L≈344.6mL,所以选用量气管的适宜规格是400mL,故选C。
L≈344.6mL,所以选用量气管的适宜规格是400mL,故选C。
(2)检查装置气密性,首先要密闭,应关闭分液漏斗(a)活塞,然后形成压强差,并产生明显现象,应微热圆底烧瓶,所以检查A装置气密性的操作可以是:关闭分液漏斗(a)活塞,用热毛巾(或双手)捂热圆底烧瓶,一段时间后C中浸入液体中的导气管末端有气泡冒出,移开热毛巾(或双手)后C中导气管中上升一段稳定的水柱,则气密性良好。为使仪器a(分液漏斗)中的硫酸顺利加入圆底烧瓶,需要平衡a(分液漏斗)中压强,使之与空气连通,故应打开分液漏斗(a)的瓶塞(玻璃塞)(或者使瓶塞上的凹槽对准分液漏斗颈部的小孔)。
(3)氢氧化钠吸收的是SO2气体,所以一定发生反应:Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,0.8gSO2的物质的量为:0.8g÷64g/mol=0.0125mol,1.0g锌的物质的量为:1.0g÷65g/mol≈0.0154mol>0.0125mol,所以还会发生反应:Zn+H2SO4=ZnSO4+H2↑。
(4)由已知,n(H2SO4)=cVmol,氢氧化钠洗气瓶增重mg,则n(SO2)= ![]() mol,根据反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,消耗硫酸为2×
mol,根据反应Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O,消耗硫酸为2×![]() mol,所以生成H2的H2SO4为:(cV-2×
mol,所以生成H2的H2SO4为:(cV-2×![]() )mol,则n(H2)=(cV-2×
)mol,则n(H2)=(cV-2×![]() )mol,故
)mol,故![]() =
=![]() 。若撤走B装置,A中产生的水蒸气进入装置C中使n(SO2)的计算结果偏大,则算得n(H2)偏小,
。若撤走B装置,A中产生的水蒸气进入装置C中使n(SO2)的计算结果偏大,则算得n(H2)偏小, ![]() 的数值将偏小。
的数值将偏小。
(5)Zn与硫酸的反应是放热反应,温度升高,气体受热膨胀,此时读出的气体体积偏大,因此要恢复到室温状态;因为测得的体积需要转化到标准状况,而量气管中的压强不容易测量,可以调节量气管左右液面相平,量气管中的压强即等于室内压强;读数时,视线与凹液面最低处相平,总之为准确测量气体体积,量气管在读数时要消除内外气体压强不相等及视线不正确而造成的误差,所以应注意的操作有:①读数前移动b使量气管左右液面相平;②视线与量气管凹液面最低点在同一水平面;③待装置冷却至室温读数。

 口算能手系列答案
口算能手系列答案