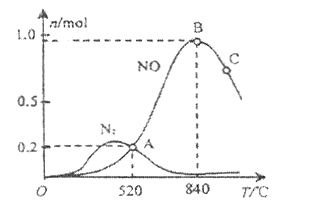
题目内容
【题目】下列图像均为实验过程中产生沉淀的物质的量与加入试剂的量之间的关系图,其中错误的是


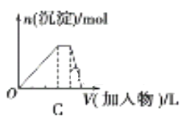

A. 图A表示向MgCl2、AlCl3和盐酸的混合溶液中逐滴滴入NaOH溶液至过量
B. 图B表示将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系
C. 图C表示向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D. 图D表示向烧碱溶液中滴加明矾溶液
【答案】D
【解析】
A、MgCl2和AlCl3和盐酸的混合溶液中滴加NaOH溶液,先发生中和反应,故开始无沉淀;再发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓,生成两种沉淀,沉淀量随着氢氧化钠的量增大而增大,继续加入氢氧化钠溶液,发生Al(OH)3+NaOH═NaAlO2+2H2O,最后氢氧化铝溶解而氢氧化镁不溶解,沉淀的量不变,选项A正确;B、将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,发生反应先后顺序为Ba(OH)2+CO2=BaCO3↓+H2O、2KOH+CO2=K2CO3+H2O、2KAlO2+CO2+3H2O=2Al(OH)3↓+K2CO3、K2CO3+CO2+H2O=2KHCO3、BaCO3+H2O+CO2=Ba(HCO3)2,根据物质的溶解性知,沉淀量与通入二氧化碳关系图相符,选项B正确;C. Al3+结合氢氧根离子的能力强于NH4+,发生离子反应:Al3++3OH-=Al(OH)3↓、NH4++OH-=NH3H2O、Al(OH)3+OH-=AlO2-+2H2O,消耗氢氧化钠的物质的量之比为3:1:1,选项C正确;D、形成1 mol偏铝酸根离子需要1 mol铝离子,消耗1 mol偏铝酸根离子却只需要![]() mol铝离子,与图中比例不符,选项D错误;答案选D。
mol铝离子,与图中比例不符,选项D错误;答案选D。

 阅读快车系列答案
阅读快车系列答案