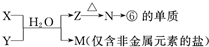
题目内容
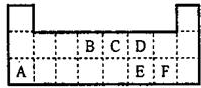 如图为元素周期表的一部分.表中所列的字母分别代表某一元素.
如图为元素周期表的一部分.表中所列的字母分别代表某一元素.(1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为
11.2L
11.2L
.(2)写出B、C、D氢化物的稳定性由强到弱为
H2O>NH3>CH4
H2O>NH3>CH4
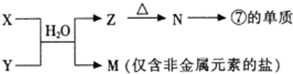
.(3)表中的另一种金属元素(未标出)的单质G,可以发生如下图所示转化
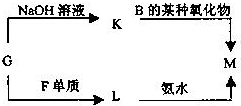
其中化合物M是一种白色胶状沉淀,则M的化学式为
Al(OH)3
Al(OH)3
;K的溶液与过量B的某种氧化物反应的离子方程式为
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
.分析:(1)根据金属钠和水反应的方程式进行计算;
(2)同周期元素的原子,从左到右非金属性逐渐增强,氢化物的稳定性逐渐增强;
(3)推断题的突破口是能和氢氧化钠反应的金属是Al,和Al相关的白色胶状沉淀是氢氧化铝;
(2)同周期元素的原子,从左到右非金属性逐渐增强,氢化物的稳定性逐渐增强;
(3)推断题的突破口是能和氢氧化钠反应的金属是Al,和Al相关的白色胶状沉淀是氢氧化铝;
解答:解:根据元素在周期表中的分布,可以推知:A是Na,B是C,C是N,D是O,E是S,F是Cl.
(1)金属钠和水反应的方程式为2Na+2H2O=2NaOH+H2↑,1molNa与水完全反应产生氢气的物质的量是0.5mol,体积是0.5mol×22.4L/mol=11.2L,故答案为:11.2L;
(2)C、N、O是同周期元素的原子,从左到右氢化物的稳定性逐渐增强,所以稳定性由强到弱为H2O>NH3>CH4,故答案为:H2O>NH3>CH4;
(3)能和氢氧化钠反应的金属是Al,即G是Al,K是偏铝酸钠溶液,能和二氧化碳反应生成氢氧化铝,反应的实质是:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:Al(OH)3;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
(1)金属钠和水反应的方程式为2Na+2H2O=2NaOH+H2↑,1molNa与水完全反应产生氢气的物质的量是0.5mol,体积是0.5mol×22.4L/mol=11.2L,故答案为:11.2L;
(2)C、N、O是同周期元素的原子,从左到右氢化物的稳定性逐渐增强,所以稳定性由强到弱为H2O>NH3>CH4,故答案为:H2O>NH3>CH4;
(3)能和氢氧化钠反应的金属是Al,即G是Al,K是偏铝酸钠溶液,能和二氧化碳反应生成氢氧化铝,反应的实质是:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:Al(OH)3;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评:本题是一道关于元素周期表知识的综合题目,考查角度广,难度较大.

练习册系列答案
相关题目

 如图为元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的
如图为元素周期表的一部分.X、Y、Z、W均为短周期元素,若W原子的最外层电子数是其次外层电子数的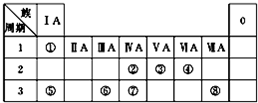 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: