题目内容
【题目】“新时代”的中学生应具备一定的化学科学素养。下列描述中,不符合化学基本原理的是
A. 电解熔融的氧化铝制取金属铝,不能用铁作阳极
B. 垃圾是污染物,一定条件下还可能产生二次污染
C. 向铁中添加一定比例的铜制成合金,防止铁制品被腐蚀
D. 治理雾霾的根本方法是从源头上控制形成雾霾的污染物
【答案】C
【解析】
A. 电解熔融的氧化铝制取金属铝,用铁作阳极时,铁放电生成亚铁离子,开始时阴极析出少量铝,但由于![]() 的氧化性比
的氧化性比![]() 的氧化性强,当
的氧化性强,当![]() 增加到一定浓度时,阴极只析出铁,得不到金属铝,故A项正确; B.垃圾是污染物,垃圾排入环境后,在物理,化学和生物的作用下,生成新的污染物对环境产生二次污染。故B对。C. 向铁中添加一定比例的铜制成合金,会形成铁铜原电池,铁做负极失电子被腐蚀。故C错;D. 治理雾霾的根本方法是从源头上控制形成雾霾的污染物,故D正确。综上所述,本题答案:C。
增加到一定浓度时,阴极只析出铁,得不到金属铝,故A项正确; B.垃圾是污染物,垃圾排入环境后,在物理,化学和生物的作用下,生成新的污染物对环境产生二次污染。故B对。C. 向铁中添加一定比例的铜制成合金,会形成铁铜原电池,铁做负极失电子被腐蚀。故C错;D. 治理雾霾的根本方法是从源头上控制形成雾霾的污染物,故D正确。综上所述,本题答案:C。

【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁。其生产步骤如下:
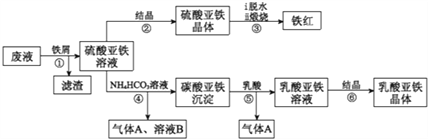
已知:TiOSO4可溶于水,在水中可以电离为TIO2+和SO42-,TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
(1)步骤①中分离硫酸重铁溶液和滤渣的操作是______________。
(2)加入铁屑的目一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2·xH2O滤渣,用平衡移动的原理解释得到滤渣的原因_______________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因___________________。
(5)步骤④的离子方程式是________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及_______________。
(7)乳酸亚佚晶体{[CH3CH(OH)COO]2Fe·3H2O}纯度的测量:若用KMnO4滴定法测定样品中Fe的量进而计算纯度时,发现结果总是大于100%,其原因可能是_______________。
经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
滴定次数 | 0.1000mol/LCe(SO4)2标准溶液/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
4 | 0.16 | 19.88 |
则产品中乳酸亚铁晶体的纯度为_______(以质量分数表示)。
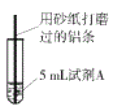
【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
实验序号 | 试剂A | 实验现象 |
1 | 0.2mol/LCuCl2溶液 | 铝条表面有气泡产生,并有红色固体析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体 | 开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出 |
3 | 2mol/LCuSO4溶液 | 铝条表面有少量气泡产生,并有少量红色固体 |
4 | 2mol/LCuCl2溶液 | 反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成 |
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
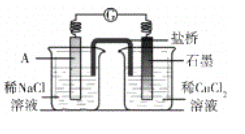
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号 | 实验操作 | 实验现象 |
i | 加入浓NaCl溶液 | 沉淀溶解,形成无色溶液 |
ii | 加入饱和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由无色变为褐色 |
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
【题目】乙苯(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:
C8H10(g) ![]() C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
C8H8(g)+H2(g) ΔH=+125 kJ·mol-1
Ⅰ.某温度下,将0.40 mol乙苯充入1 L真空密闭容器中发生上述反应,测定不同时间该容器内物质的物质的量,得到数据见下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)当反应进行到20 min时,该段时间内H2的平均生成速率是__________。
(2)该温度下,反应从开始到平衡的过程中共从环境吸收__________kJ热量。
(3)若保持反应条件不变,用0.40 mol H2(g)和0.40 mol C8H8(g)合成C8H10(g),当有25 kJ热量放出时,该反应中H2的转化率是______,此时该反应的方向是________(填“正向” 或“ 逆向”)。
Ⅱ.氢化热是指在一定条件下,1 mol不饱和化合物加氢时放出的热量,表中是环己烯(g)、1,3-环己二烯(g)和苯的氢化热数据:
物质 |
|
|
|
氢化热(kJ/mol) | 119.7 | 232.7 | 208.4 |
(4)1,3-环己二烯的稳定性________(填“大于”“小于”或“等于”)苯。
(5)某有机物是苯的同分异构体,其分子中的碳碳键角只有60度和90度两种。请写出这种有机物的键线式结构________,它在核磁共振氢谱上会产生________个吸收峰 。
(6)与环己烯互为同分异构体的炔烃共有________种(不考虑立体异构)。
