题目内容
【题目】常温下,将![]() 通入
通入![]() 的KOH溶液中。溶液中水电离出的
的KOH溶液中。溶液中水电离出的![]() 离子浓度
离子浓度![]() 与通入的
与通入的![]() 的体积
的体积![]() 的关系如图所示。下列叙述不正确的是
的关系如图所示。下列叙述不正确的是
 A
A
A.a点溶液中:水电离出的![]()
B.b点溶液中:![]()
C.c点溶液中:![]()
D.d点溶液中:![]()
【答案】B
【解析】
根据题中溶液中水电离出的![]() 离子浓度
离子浓度![]() 与通入的
与通入的![]() 的体积
的体积![]() 的关系可知,本题考查离子浓度大小比较,根据溶液中的溶质及其性质结合电荷守恒进行分析。
的关系可知,本题考查离子浓度大小比较,根据溶液中的溶质及其性质结合电荷守恒进行分析。
a点为氢氧化钾溶液,a到c是生成碳酸钾,b点是碳酸钾和氢氧化钾的混合溶液,c点是单一的碳酸钾溶液,c到d是生成碳酸氢钾,d点是碳酸氢钾和碳酸的混合溶液,d点溶液呈中性,
A.a点溶液中的溶质是KOH,氢氧化钾抑制了水的电离,溶液中氢离子是水电离的,则水电离出的![]() ,故A正确;
,故A正确;
B.b点是碳酸钾和氢氧化钾的混合溶液,所以溶液呈碱性,溶液中的![]() ,故B错误;
,故B错误;
C.c点溶液中,当水电离出的![]() 离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:
离子浓度最大时,说明此时的溶液是碳酸钾溶液,根据碳酸钾溶液中的物料守恒可得:![]() ,故C正确;
,故C正确;
D.d点溶液中水电离出的![]() 离子浓度
离子浓度![]() ,溶液呈中性,
,溶液呈中性,![]() ,结合电荷守恒
,结合电荷守恒![]() ,两式相减得:
,两式相减得:![]() ,故D正确;
,故D正确;
答案选B。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
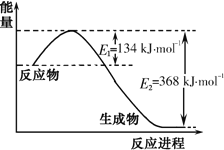
(1)如图是1mol![]() 气体和1molCO反应生成
气体和1molCO反应生成![]() 和NO过程中能量变化示意图。则反应过程中放出的总热量应为______。
和NO过程中能量变化示意图。则反应过程中放出的总热量应为______。
(2)在固定体积的密闭容器中,进行如下化学反应:
![]() ;
;![]() ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:
| 298 | 398 | 498 |
平衡常数K |
|
|
|
①写出该反应的平衡常数表达式![]() ______。
______。
②试判断K1______ K2 (填写“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③下列各项能说明该反应已达到平衡状态的是______![]() 填字母
填字母![]() .
.
![]() 容器内
容器内![]() 、
、![]() 、
、![]() 的浓度之比为1:3:2
的浓度之比为1:3:2![]()
![]() 容器内压强保持不变
容器内压强保持不变 ![]() 混合气体的密度保持不变
混合气体的密度保持不变
(3)化合物![]()
![]() 做火箭发动机的燃料时,与氧化剂
做火箭发动机的燃料时,与氧化剂![]() 反应生成
反应生成![]() 和水蒸气。某同学设计了一个
和水蒸气。某同学设计了一个![]()
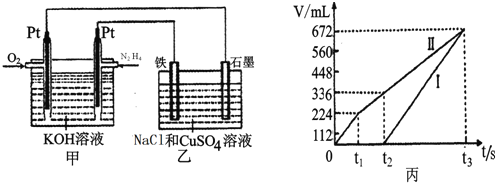
![]() 空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与
空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与![]() 混合溶液,其装置如图所示:
混合溶液,其装置如图所示:
①该燃料电池的负极反应式为______;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示![]() 气体体积已换算成标准状况下的体积
气体体积已换算成标准状况下的体积![]() ,写出在
,写出在![]() 时间段铁电极上的电极反应式______;原混合溶液中NaCl的物质的量浓度为______。
时间段铁电极上的电极反应式______;原混合溶液中NaCl的物质的量浓度为______。
③在![]() 时所得溶液的pH为______(假设溶液体积不变
时所得溶液的pH为______(假设溶液体积不变![]()
【题目】某小组同学对FeCl3与KI的反应进行探究。
(初步探究)室温下进行下表所列实验。
序号 | 操作 | 现象 |
实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________。
(2)写出实验Ⅰ反应的离子方程式:_________________。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________。
(深入探究)20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素可能是_____________(写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2![]() I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________。