题目内容
3.将Na、Na2O、Na2O2的混合物4.34g与足量的水反应,在标准状况下得到672mL混合气体,放电条件下,气体之间恰好完全反应,则它们的物质的量之比为( )| A. | 1:1:1 | B. | 1:2:1 | C. | 1:1:2 | D. | 4:3:2 |
分析 Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的化学计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比,据此判断.
解答 解:钠与水、过氧化钠与水、氢气与氧气的反应方程式如下:
2Na+2H2O=2NaOH+H2↑
2Na2O2+2H2O=4NaOH+O2↑
2H2+O2$\frac{\underline{\;放电\;}}{\;}$2H2O
将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,即氢气和氧气的物质的量之比为2:1,
由方程式可得钠与过氧化钠的关系式为:4Na--2H2--O2--2Na2O2
所以钠与过氧化钠的物质的量之比为4:2=2:1,而氧化钠的物质的量不确定,
显然D中符合钠与过氧化钠的物质的量之比为2:1,
故选D.
点评 本题考查混合物有关计算,属于无数据计算,难度中等,关键在于氢气与氧气恰好完全反应,再根据方程式中定量比例关系解答.

练习册系列答案
相关题目
15.已知:硫酸溶液的浓度越大,密度越大.现将50g溶质质量分数为w1,物质的最浓度c1的硫酸沿玻璃棒加入到Vm1水(设水的密度为1g/ml)中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
| A. | 若c1=2c2,则w1<2w2,V<50mL | B. | 若c1=2c2,则w1<2w2,V=50mL | ||
| C. | 若w1=2w2,则c1<2c2,V>50mL | D. | 若w1=2w2,则c1>2c2,V<50mL |
11.从下列事实所列出的相应结论正确的是( )
| A. | Cl2的水溶液可以导电---Cl2是电解质 | |
| B. | SO2通入硝酸钡溶液出现白色沉淀---BaSO3不溶于强酸 | |
| C. | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀---结合H+的能力:CO${\;}_{3}^{2-}$<AlO${\;}_{2}^{-}$ | |
| D. | 常温下白磷可自燃而氮气须在放电时才与氧气反应---非金属性:P>N |
18.某电化学装置如图(A为Zn,B为Cu),下列说法正确的是( )


| A. | 若X是盐桥,则电子由B电极经外电路流向A电极 | |
| B. | 若X是铜条,则A电极的电极反应式是:Zn2++2e-═Zn | |
| C. | 若X是石墨条,则乙池溶液的PH不变 | |
| D. | 若X 是锌条,则A电极的质量会减小 |
12.关于NO的下列叙述中不正确的是( )
| A. | NO是无色气体 | |
| B. | NO气体难溶于水 | |
| C. | 打开盛NO气体的瓶盖,立即看到瓶口有红棕色气体生成 | |
| D. | NO是无毒气体 |
13.从海水中可以提取溴,主要反应之一为2Br-+Cl2═2Cl-+Br2,下列有关说法中正确的是( )
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于复分解反应 | D. | 氯气氧化性比溴单质强 |
 $→_{Fe}^{Br_{2}}$A$→_{K_{2}CO_{3}丙酮}^{B(CH_{2}=CHCH_{2}Br)}$
$→_{Fe}^{Br_{2}}$A$→_{K_{2}CO_{3}丙酮}^{B(CH_{2}=CHCH_{2}Br)}$ $→_{THF}^{Mg}$ $\stackrel{B}{→}$C$→_{2H_{3}O+}^{1Li,THF,室温}$D
$→_{THF}^{Mg}$ $\stackrel{B}{→}$C$→_{2H_{3}O+}^{1Li,THF,室温}$D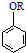 $→_{H_{3}O+}^{Li,THF,室温}$
$→_{H_{3}O+}^{Li,THF,室温}$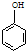

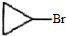 是B的一种同分异构体,核磁共振氢谱证明它有2种不同的化学环境的氢.
是B的一种同分异构体,核磁共振氢谱证明它有2种不同的化学环境的氢.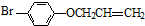 的反应类型取代反应.
的反应类型取代反应.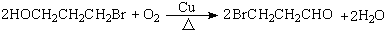 .
.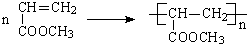 .
. .
.