题目内容
【题目】用电解法测量某工业废气中CO的浓度,工作原理如图所示。下列说法正确的是
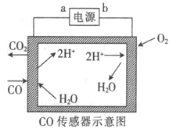
A.b为电源的正极B.阳极的电极反应式为CO+H2O-2e-=CO2+2H+
C.H+向阳极移动D.理论上每消耗11.2 L O2,转移2 mol电子
【答案】B
【解析】
根据示意图,在左侧,CO和水生成了CO2和H+,则CO中C的化合价升高,发生氧化反应,在电解池中阳极发生氧化反应,则a为电源的正极,阳极反应为CO-2e-+H2O=CO2+2H+;b为电源的负极,根据图示,阴极反应为2H++2e-=H2↑。
A、根据图示,右侧,H+得到电子,生成H2,发生还原反应,电解池中阴极发生还原反应,则b为电极的负极,A错误;
B、根据示意图,左侧,CO和水生成了CO2和H+,CO中C的化合价升高,发生氧化反应,阳极反应为CO-2e-+H2O=CO2+2H+;B正确;
C、电解池中,阳离子向阴极移动,H+向阴极移动,C错误;
D、没有说明气体所处的状态,无法得知11.2LO2的物质的量,D错误;
答案选B。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目