题目内容
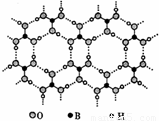
[化学--物质结构与性质]硼酸能够吸收中子,屏蔽核辐射.硼酸晶体具有层状结构,其每一层结构如图所示.
(1)硼酸晶体属于______(填“离子晶体”、“分子晶 体”或“原子晶体”),B元素的电负性______O元素(填“>”或“<”).
(2)硼酸晶体中,B的杂化轨道类型是______.
(3)硼酸晶体中,微粒间的作用力类型有______.
(4)硼酸是一元弱酸,其呈酸性的机理是:硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,导致溶液中c(H+)>c(OH-).Y-的结构简式是______;硼酸与水作用时,每生成一个Y-,断裂______个σ键.
(5)三氟化硼水解生成硼酸和氟硼酸(H[BF4]),BF4-的空间结构与CH4相似.BF4-和BF3中硼氟键的键长如表所示.
| BF4- | BF3 | |
| 键长/pm | 152 | 130 |
【答案】分析:(1)硼酸为白色结晶性粉末,分子式为:H3BO3,电负性是元素的原子在分子中吸引共用电子的能力;
(2)sp2杂化轨道由1个ns轨道和2个np轨道组合而形成,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分;
(3)化学键是指分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用;
(4)抓住题目中的信息硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,解题;
(5)键长越短,分子的化学性质越不稳定,从表中数据可以看出,BF3中硼氟键的键长比BF4-的B-F键的键长短,说明硼氟键作用力强;
解答:解:(l)硼酸晶体中存在H3BO3分子,因此,是分子晶体,元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;电负性数值越小,相应原子在化合物中吸引电子的能力越弱,氧的电负性为:3.44,硼的电负性为 2.04.
故答案为:分子晶体,<;
(2)在硼酸[B(OH)3]分子中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与3个羟基相连,无孤对电子对,故答案为:sp2杂化;
(3)在硼酸[B(OH)3]分子中,硼原子与氧原子形成共价健、羟基中氢原子和氧原子间形成共价键,硼酸分子与硼酸分子间形成氢键、范德华力.故答案为:共价健、氢键、范德华力;
(4)硼酸与水作用,B(OH)3+H20? +H+,共价单键是σ键.故答案为:
+H+,共价单键是σ键.故答案为:
( 或
或 ) 1
) 1
(5)π键是由两个p轨道从侧面重叠而形成.故答案为:BF3中的B与F原子之间还有π键形成(或BF3中的硼氟键具有一定程度的双键性质等合理答案)
点评:该题难度较大,综合性强,涉及的知识点多,但这些知识点都是物质结构中的重点,平时应多注意积累总结.
(2)sp2杂化轨道由1个ns轨道和2个np轨道组合而形成,每个杂化轨道含有三分之一的s轨道成分和三分之二p轨道成分;
(3)化学键是指分子内或晶体内相邻两个或多个原子(或离子)间强烈的相互作用;
(4)抓住题目中的信息硼酸与水作用时,硼原子与水电离产生的OH-以配位键结合形成Y-离子,解题;
(5)键长越短,分子的化学性质越不稳定,从表中数据可以看出,BF3中硼氟键的键长比BF4-的B-F键的键长短,说明硼氟键作用力强;
解答:解:(l)硼酸晶体中存在H3BO3分子,因此,是分子晶体,元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;电负性数值越小,相应原子在化合物中吸引电子的能力越弱,氧的电负性为:3.44,硼的电负性为 2.04.
故答案为:分子晶体,<;
(2)在硼酸[B(OH)3]分子中,硼原子最外层只有3个电子,与氧原子形成3对共用电子对,B原子与3个羟基相连,无孤对电子对,故答案为:sp2杂化;
(3)在硼酸[B(OH)3]分子中,硼原子与氧原子形成共价健、羟基中氢原子和氧原子间形成共价键,硼酸分子与硼酸分子间形成氢键、范德华力.故答案为:共价健、氢键、范德华力;
(4)硼酸与水作用,B(OH)3+H20?
 +H+,共价单键是σ键.故答案为:
+H+,共价单键是σ键.故答案为:(
 或
或 ) 1
) 1(5)π键是由两个p轨道从侧面重叠而形成.故答案为:BF3中的B与F原子之间还有π键形成(或BF3中的硼氟键具有一定程度的双键性质等合理答案)
点评:该题难度较大,综合性强,涉及的知识点多,但这些知识点都是物质结构中的重点,平时应多注意积累总结.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

 ”表示该晶体中的一个原子,请在该立方体的顶点上用“
”表示该晶体中的一个原子,请在该立方体的顶点上用“ ”表示出与之紧邻的原子.
”表示出与之紧邻的原子.

 ,平面结构)属于
,平面结构)属于 (2013?菏泽二模)[化学-物质结构与性质]
(2013?菏泽二模)[化学-物质结构与性质]