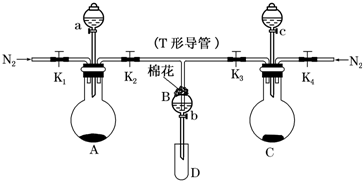
题目内容
3.工业上从铝土矿(主要成分是Al2O3,还含有SiO2、Fe2O3等杂质)中提取铝可采用如下工艺流程: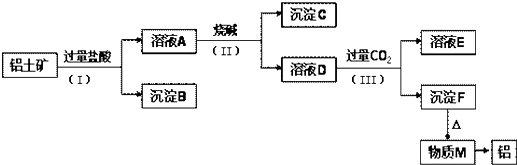
请回答下列问题:
(1)步骤(Ⅱ)中加入的烧碱溶液应该是过量(填“少量”或“过量”) 其反应的离子方程式为Al3++4OH-=AlO2-+2H2O,得到沉淀C的颜色红褐色;
(2)沉淀B和NaOH焙烧制备一种有黏性的化工原料,其反应的化学方程式为SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+H2O,可采用的装置为B(填代号);

(3)溶液D中含铝元素的溶质属于盐(填“酸”、“碱”、“盐”)类物质.溶液D中通入过量CO2生成沉淀F的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
(4)请写出上述流程中涉及的氧化还原反应的化学方程式:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
分析 铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,铝土矿和过量HCl混合,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2和HCl不反应,所以沉淀B是SiO2,滤液A中成分是 AlCl3、FeCl3和HCl,向滤液A中加入过量NaOH溶液,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、NaOH+HCl=NaCl+H2O,则滤液D中含有NaCl、NaOH、NaAlO2,沉淀C为Fe(OH)3,向滤液D中通入过量二氧化碳,发生反应NaOH+CO2=NaHCO3、AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,沉淀F为Al(OH)3,溶液E中成分是NaHCO3,加热沉淀F,氢氧化铝分解生成M为Al2O3,电解熔融Al2O3得到Al,由此分析解答.
解答 解:铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3,铝土矿和过量HCl混合,发生反应Al2O3+6HCl=2AlCl3+3H2O、Fe2O3+6HCl=2FeCl3+3H2O,SiO2和HCl不反应,所以沉淀B是SiO2,滤液A中成分是 AlCl3、FeCl3和HCl,向滤液A中加入过量NaOH溶液,发生反应AlCl3+4NaOH=NaAlO2+2H2O+3NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、NaOH+HCl=NaCl+H2O,则滤液D中含有NaCl、NaOH、NaAlO2,沉淀C为Fe(OH)3,向滤液D中通入过量二氧化碳,发生反应NaOH+CO2=NaHCO3、AlO2-+CO2(过)+2H2O=Al(OH)3↓+HCO3-,沉淀F为Al(OH)3,溶液E中成分是NaHCO3,加热沉淀F,氢氧化铝分解生成M为Al2O3,电解熔融Al2O3得到Al,
(1)根据上面的分析可知,步骤(Ⅱ)中加入的烧碱溶液应该是过量,其反应的离子方程式为Al3++4OH-=AlO2-+2H2O,得到沉淀C为Fe(OH)3,颜色为红褐色,
故答案为:过量;Al3++4OH-=AlO2-+2H2O;红褐色;
(2)沉淀B是SiO2,SiO2和NaOH焙烧制备一种有黏性的化工原料,其反应的化学方程式为SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+H2O,由于瓷坩埚中有二氧化硅能与氢氧化钠反应,所以加热时可采用的装置为铁坩埚,故选B,
故答案为:SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+H2O;B;
(3)溶液D中含铝元素的溶质为偏铝酸钠,属于盐,溶液D中通入过量CO2生成沉淀F的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:盐;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(4)根据流程图,反应前后的化合价变化的只有最后一步,反应为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,故答案为:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅清楚提取的操作过程原理,而且需熟知物质间的反应,能熟练对知识迁移进行综合运用是解答的关键,题目难度中等.

(1)钪(Sc)元素的原子核外电子排布式为1s22s22p63s23p63d14s2.钬(Ho)的基态原子电子排布式为[Xe]4f116s2,一个基态钬原子所含的未成对电子数为3.
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价.请根据下表中的电离能数,判断表中最可能有+4价的元素是Ce.
几种稀土元素的电离能(单位:kJ•mol-1)
| 元素 | I1 | I2 | I3 | I1+I2+I3 | I4 |
| Sc(钪) | 633 | 1235 | 2389 | 4257 | 7019 |
| Y(钇) | 616 | 1181 | 1980 | 3777 | 5963 |
| La(镧) | 538 | 1067 | 1850 | 3455 | 4819 |
| Ce(铈) | 527 | 1047 | 1949 | 3523 | 3547 |
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2.
ICH2CH2I中碳原子杂化轨道类型为sp3,1mol CH2=CH2中含有的σ键数目为5NA.
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点则PrO2(二氧化镨)的晶胞中有9个氧原子.
(6)Ce(铈)单质为面心立方晶体,其晶胞参数为a=516pm.晶胞中Ce(铈)原子的配位数为12.列式表示Ce(铈)单质的密度为$\frac{4×140}{6.02×1{0}^{23}×(516×1{0}^{-10})^{3}}$g•cm-3(不必计算出结果).
| A. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl | |
| B. |  +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ +H2O +H2O | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O | |
| D. | CH2═CH2+HCl→CH3CH2Cl |
(1)y的数值是4,
(2)并判断x与z的大小关系x=z.
| A. | 标准状况下,22.4 L H2O含有的分子数为1NA | |
| B. | 16 g O2和O3的混合气体所含的氧原子数为NA | |
| C. | 1 mol Na2O2与水反应的过程中转移的电子数目为2NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
| A. | 氯气溶解于水:Cl2+H2O═HClO+Cl-+H+ | |
| B. | 沸水中滴入饱和FeCl3溶液,溶液呈红褐色:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | 醋酸钠溶液显碱性:CH3COO-+H2O═CH3COOH+OH-. | |
| D. | 久置的H2S 溶液变浑浊:2S2-+O2+4H+═2S↓+2H2O |
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:Na+、S2-、SO32-、SO42- | |
| B. | c(H+)=1×l0-13mol/L的溶液中:K+、SO42-、Cl-、C6H5O- | |
| C. | 与铝反应产生大量氢气的溶液中:I-、Al3+、Na+、NO3- | |
| D. | 含有0.1mol/L Al3+的溶液中:Na+、NO3-、CO32-、NH4+ |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |