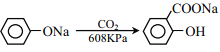
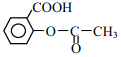题目内容
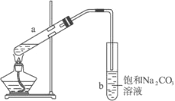
【题目】实验室制取乙烯的反应原理为:CH3CH2OH![]() CH2=CH2↑+H2O,选用下图A进行反应。但常因温度过高而使乙醇和浓硫酸生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中存在乙烯和二氧化硫,试回答下列问题。
CH2=CH2↑+H2O,选用下图A进行反应。但常因温度过高而使乙醇和浓硫酸生成少量的二氧化硫。有人设计下列实验以确认上述混合气体中存在乙烯和二氧化硫,试回答下列问题。
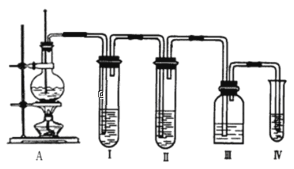
(1)将下列所给的试剂中选出所必需的试剂,按气流方向从左到右依次是:______(可重复,填字母)。
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.溴水
(2)能说明二氧化硫气体存在的现象是______。
(3)使用装置Ⅲ的目的是______。
(4)确定含有乙烯的现象是______。
(5)写出IV中发生的化学反应方程式______。
【答案】ABADI中品红溶液褪色检验SO2是否除尽Ⅲ中品红不褪色,Ⅳ中溴水褪色CH2=CH2+Br2→CH2BrCH2Br
【解析】
二氧化硫的检验用品红溶液,乙烯的检验用溴水,乙烯和二氧化硫都能使溴水褪色,所以先检验二氧化硫,然后检验乙烯,同在检验乙烯之前用NaOH溶液除去SO2,再通过品红溶液不褪色确认SO2已除干净,最后用溴水褪色检验乙烯,据此解答。
(1)因装置Ⅰ用来检验SO2,试管中品红溶液褪色,说明含有SO2,装置Ⅱ试管中装有NaOH溶液除去SO2,装置Ⅲ试管通过品红溶液不褪色确认SO2已除干净,装置Ⅳ通过溴水褪色检验乙烯,因此答案依次为ABAD;
(2)装置I用来检验SO2,因此能说明二氧化硫气体存在的现象是I中品红溶液褪色,说明含有SO2;
(3)装置Ⅲ试管通过品红溶液不褪色确认SO2已除干净,因此使用装置Ⅲ的目的是检验SO2是否除尽;
(4)装置Ⅲ试管通过品红溶液不褪色,装置Ⅳ通过溴水褪色检验乙烯,所以确定含有乙烯的现象是Ⅲ中品红不褪色,Ⅳ中溴水褪色;
(5)根据以上分析可知IV中发生溴水和乙烯的加成反应,反应的化学反应方程式为CH2=CH2+Br2→CH2BrCH2Br。

 阅读快车系列答案
阅读快车系列答案【题目】(1)肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。肼燃料电池原理如图所示,通入氧气的电极上发生的电极反应式为____________________。

(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
③如下图所示,表示NO2变化曲线的是________。

④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变