题目内容
【题目】W、X、Y、Z为短周期元素,它们在周期表中的相对位置如图所示,若这四种元素的原子最外层电子数之和为24,则下列说法不正确的是
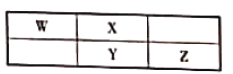
A.最高价氧化物对应水化物的酸性:Z>Y
B.W的最低价氢化物与少量Z2反应,产物除W2外,还有一种盐,其水溶液呈酸性
C.在元素周期表中,114号(类铅)元素与W元素不位于同一主族
D.Y、Z可形成YZ2、Y2Z2等分子,前者常用作橡胶硫化剂
【答案】D
【解析】
且四种元素的原子最外层电子数之和为24,设Y最外层电子数为a,X最外层为a,Z最外层为a+1,W最外层为a-1,即:4a=24,所以a=6,即X、Y分别为O和S,W和Z为N和Cl,由此分析解答。
根据上述分析可知,W、X、Y、Z分别为N、O、S和Cl,则
A. 非金属性越强,最高价氧化物对应水化物的酸性越强,因非金属性:Cl>S,所以酸性:Z>Y,A项正确;
B. 氯气具有强氧化性,氨气与氯气反应会生成氮气和氯化铵,氯化铵的水溶液中铵根离子会发生水解,使溶液呈酸性,B项正确;
C. 在元素周期表中,114号元素位于第六周期IVA,与碳元素位于同一主族,不与氮元素同族,C项正确;
D. S、Cl可形成SCl2、S2Cl2等分子,S2Cl2常用作橡胶硫化剂,而不是SCl2,D项错误;
答案选D。

【题目】硫酸镍是电镀工业必不可少的化工原料。从不锈钢废渣(主要含Fe 42.35%、Cr 9.67%、Ni 5.1%、C 4.7%、Si 3.39%等)中制取硫酸镍晶体的工艺流程如下:

已知:①Cr3+与氨水反应时有少量Cr3+生成[Cr(NH3)6]3+,但加热时该络合物易分解。Ni2+与氨水反应生成[Ni(NH3)6]2+,该络合物加热时稳定,用硫酸酸化时生成相应的硫酸盐。
②Na2CrO4溶液中加酸调节pH为3.5时,CrO42﹣转化为Cr2O72﹣。
③相关物质在不同温度时溶解度如下表:
温度溶解度/g物质 | 20℃ | 30℃ | 40℃ | 60℃ | 80℃ | 90℃ |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)“酸浸”后得到的溶液中主要含有FeSO4、NiSO4、Cr2(SO4)3,生成NiSO4的化学方程式为_____。“酸浸”时需控制温度为90℃左右,可以采用的加热方式是_____。
(2)“过滤”前,适当加热的目的是_____。
(3)对“过滤”所得的滤渣进行洗涤,检验滤渣已洗涤干净的方法是_____。
(4)“过滤”时产生的滤渣可用于制备Na2Cr2O7晶体。
①滤渣经干燥后与Na2CO3混合在空气中煅烧生成Na2CrO4和CO2,此反应的化学方程式为_____。
②请补充完整上述煅烧后混合物制备Na2Cr2O7晶体(橙红色)的实验方案:水浸,过滤,_____,得Na2Cr2O7晶体(必须使用的试剂有:硫酸,蒸馏水)。
【题目】有A、B、C、D、E五种元素。其相关信息如下:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C的基态原子2p轨道中有三个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______。
(2)C元素的第一电离能比氧元素的第一电离能_____(填“大”或“小”)。
(3)CA3分子中C原子的杂化轨道类型是______,CA3分子的空间构型是_____。
(5)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有________(填序号)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
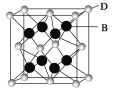
(5)B与D可形成离子化合物,其晶胞结构如图所示。其中D离子的配位数为_______。