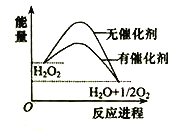
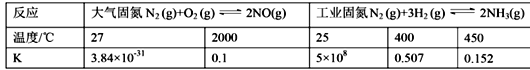
题目内容
【题目】中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g/L.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2 , 并对含量进行测定. 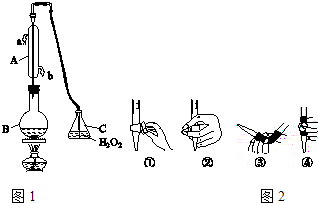
(1)仪器A的名称是 , 水通入A的进口为
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 .
(3)除去C中过量的H2O2 , 然后用0.0450mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的(填数字编号);若滴定终点时溶液的pH=8.8,则选择的指示剂为
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:g/L.
(5)该测定结果比实际值偏高的原因是,利用现有装置的改进措施是: .
【答案】
(1)冷凝管或冷凝器;b
(2)SO2+H2O2=H2SO4
(3)③;酚酞
(4)0.12
(5)盐酸易挥发;用不挥发的强酸如硫酸代替盐酸(或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响)
【解析】解:(1)根据仪器A的构造可知,仪器A为冷凝管,冷凝管中通水方向采用逆向通水法,冷凝效果最佳,所以应该进水口为b,
所以答案是:冷凝管或冷凝器;b;(2)双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4 ,
所以答案是:SO2+H2O2=H2SO4;(3)氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用③的方法;滴定终点时溶液的pH=8.8,应该选择酚酞做指示剂(酚酞的变色范围是8.2~10.0),所以答案是:③;酚酞;(4)根据2NaOH~H2SO4~SO2可知SO2的质量为: ![]() ×(0.0450mol/L×0.025L)×64g/mol=0.036g,该葡萄酒中的二氧化硫含量为:
×(0.0450mol/L×0.025L)×64g/mol=0.036g,该葡萄酒中的二氧化硫含量为: ![]() =0.12g/L,
=0.12g/L,
所以答案是:0.12;(5)由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
所以答案是:盐酸易挥发;用不挥发的强酸如硫酸代替盐酸(或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响).

 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
Y | ||
X | ||
Z |
A.Y是非金属性最强的元素
B.Z是金属元素
C.Y的原子序数为a-7
D.X的气态氢化物化学式为H2X
【题目】用提供的试剂(溴水、浓硝酸 、碘水、新制氢氧化铜浊液)分别鉴别下列有机物,将所用试剂及产生的现象的序号填在横线上。
序号 | 待鉴别的物质 | 试剂 | 现象 |
① | 乙烯 | _____ | ____________ |
② | 葡萄糖 | _____ | ___________ |
③ | 淀粉 | _____ | ___________ |