题目内容
11.I.依据2AgNO3+Cu═Cu(NO3)2+2Ag 在图1画出符合该反应的双液原电池装置图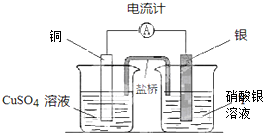 .
.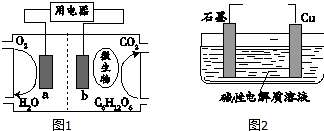
II.以葡萄糖为燃料的微生物燃料电池原理为C6H12O6+6O2═6CO2+6H2O 结构如图2所示.
(1)电极a为正极(填“正极”或“负极”),该电极反应式6O2+24H++24e-=12H2O.
(2)电池内部H+移向a(填“a”或“b”).
(3)基于绿色化学理念设计的电解池可以制取Cu2O,电解总反应为:2Cu+H2O通电═Cu2O+H2↑,若以上述微生物燃料电池作为电源,试回答下列问题:
①电极Cu为阳极(填“阳极”或“阴极”).
②石墨电极上有无色气体生成,该电极反应式2H++2e-=H2↑.
③当有0.1mol C6H12O6发生反应时,生成1.2mol Cu2O.
(4)燃料电池中,助燃剂(氧化剂)不一定是氧气.例如,以铂为电极,H2-Cl2-KOH溶液构成燃料电池,该燃料电池负极反应式为H2+2OH--2e-=2H2O.
分析 I.依据2AgNO3+Cu═Cu(NO3)2+2Ag 设计双液原电池,则Cu为负极,插在硫酸铜溶液中,Ag为正极插在硝酸银溶液中,用盐桥连接;
II.燃料电池中通入氧气的一极为正极,通入燃烧的一极为负极;
(1)正极上氧气得电子生成水;
(2)阳离子向正极移动;
(3)电解时Cu在阳极失电子,氢离子在阴极得电子,结合串联电路中电子守恒计算;
(4)碱性条件下,氢气失电子生成水.
解答 解:I.依据2AgNO3+Cu═Cu(NO3)2+2Ag 设计双液原电池,则Cu为负极,插在硫酸铜溶液中,Ag为正极插在硝酸银溶液中,用盐桥连接,则原电池装置图为: ;
;
故答案为: ;
;
II.燃料电池中通入氧气的一极为正极,通入燃烧的一极为负极;
(1)a电极通入氧气,所以a为正极,正极上氧气得电子生成水,其电极方程式为:6O2+24H++24e-=12H2O;
故答案为:正极;6O2+24H++24e-=12H2O;
(2)阳离子向正极移动,a为正极,则电池内部H+移向a极移动;
故答案为:a;
(3)已知电解总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑,电解时Cu在阳极失电子,氢离子在阴极得电子;
①电解时Cu失电子为阳极;
故答案为:阳极;
②石墨电极上有无色气体生成,该电极上为氢离子得电子生成氢气的反应,其电极反应式2H++2e-=H2↑;
故答案为:2H++2e-=H2↑;
③由C6H12O6~6O2~24e-~12Cu2O可知,当有0.1mol C6H12O6发生反应时,转移电子为2.4mol,生成1.2mol Cu2O;
故答案为:1.2;
(4)碱性条件下,氢气失电子生成水,其负极反应式为H2+2OH--2e-=2H2O;
故答案为:H2+2OH--2e-=2H2O.
点评 本题考查了原电池的设计、电化学电极反应式的书写、电解的计算等知识,明确发生的电解反应及反应中转移的电子数即可解答,注意把握原电池原理和电解池原理是解答本题的关键,题目难度中等.

| A. | 电池充电过程中,阴极附近溶液的c(OH-)降低 | |
| B. | 电池放电时,负极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
| 实验操作 | 实验目的 | |
| A | 苯和溴水混合后加入铁粉 | 制溴苯 |
| B | 某有机物与溴的四氯化碳溶液混合 | 确认该有机物含碳碳双键 |
| C | 乙醇与高锰酸钾酸性溶液混合 | 乙醇具有还原性 |
| D | 将溴乙烷与氢氧化钠水溶液共热一段时间,冷却,向其中滴加硝酸银溶液 | 检验溴乙烷中的溴原子 |
| A. | A | B. | B | C. | C | D. | D |
①银氨溶液
②新制的Cu(OH)2悬浊液
③NaOH溶液
④溴水.
| A. | 仅①④ | B. | 仅②③ | C. | ①②③④ | D. | 仅①②④ |
| A. | 试管 | B. | 蒸发皿 | C. | 烧瓶 | D. | 坩埚 |
| A. | HCO3-、Ca2+、Ba2+、Na+ | B. | Ca2+、NO3-、Mg2+、SO42- | ||
| C. | Fe3+、Cu2+、NO3-、Cl-C | D. | SO32-、MnO4-、S2-、Na+ |
| A. | 最后得到的溶液中可能有Fe3+ | B. | 残余固体一定全部是铜 | ||
| C. | 最后得到的溶液中只含Cu2+ | D. | 残余固体可能为铁、铜混合物 |
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 某钠盐溶于盐酸,产生气体 | 使澄清石灰水变浑浊 | 说明该钠盐一定是Na2CO3 |
| B | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+,无K+ |
| C | 等物质的量浓度NaHCO3和Na2CO3与等浓度的稀盐酸反应 | NaHCO3更剧烈 | HCO3-结合H+的能力比CO32-结合H+的能力强 |
| D | 向AlCl3溶液中加放足量的氨水 | 有白色沉淀产生且白色沉淀不消失 | 氨水呈弱碱性 |
| A. | A | B. | B | C. | C | D. | D |
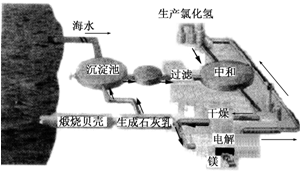 工业上“从海水中提取镁”的流程图如图所示.
工业上“从海水中提取镁”的流程图如图所示.