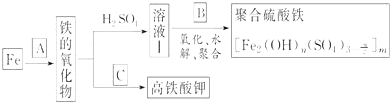
题目内容
【题目】下列体系中,离子可能大量共存的是( )
A.滴加KSCN显红色的溶液:NH、K+、Cl-、HCO
B.常温,水电离出的c(H+)=1×10-12 mol/L的溶液:Fe2+、Mg2+、SO![]() 、NO
、NO
C.使酚酞试剂显红色的溶液:Na+、Ba2+、NO、[Al(OH)4]-
D.加入Al能产生H2的溶液:K+、NH、CH3COO-、Cl-
【答案】C
【解析】
A.滴加KSCN显红色的溶液中含有铁离子,铁离子与HCO3-发生双水解反应,在溶液中不能大量共存,故A不符合题意;
B.常温下,水电离出的c(H+)=1×10-12mol/L的溶液为酸或碱溶液,Fe2+、Mg2+与氢氧根离子反应生成沉淀,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故B不符合题意;
C.使酚酞试剂显红色的溶液呈碱性,Na+、Ba2+、NO3-、[Al(OH)4]-之间不反应,且都不与氢氧根离子反应,能够大量共存,故C符合题意;
D.加入Al能产生H2的溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,CH3COO-与氢离子反应,在溶液中不能大量共存,故D不符合题意;
故选C。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】工业上可用下列仪器组装一套装置来测定黄铁矿(主要成分FeS2)中硫的质量分数(忽略SO2、H2SO3与氧气的反应)。实验的正确操作步骤如下:
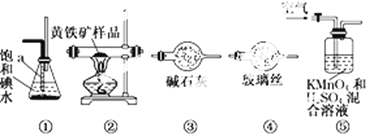
A.连接好装置,并检查装置的气密性
B.称取研细的黄铁矿样品
C.将2.0 g样品小心地放入硬质玻璃管中
D.以1 L/min的速率鼓入空气
E.将硬质玻璃管中的黄铁矿样品加热到800℃~850℃
F.用300 mL的饱和碘水吸收SO2,发生的反应是:I2+SO2+2H2O = 2HI+H2SO4
G.吸收液用CCl4萃取、分离
H.取20.00mLG中所得溶液,用0.2000mol·L-1的NaOH标准溶液滴定。试回答:
(1)步骤G中所用主要仪器是______,应取_______ (填“上”或“下”)层溶液进行后续实验。
(2)装置正确的连接顺序是 ![]()
![]()
![]() ④
④ ![]() (填编号)。______
(填编号)。______
(3)装置⑤中高锰酸钾的作用是__________。持续鼓入空气的作用__________。
(4)步骤H中滴定时应选用_____作指示剂,可以根据________现象来判断滴定已经达到终点。
(5)假定黄铁矿中的硫在操作E中已全部转化为SO2,并且被饱和碘水完全吸收,滴定得到的数据如下表所示:
滴定次数 | 待测液的体积/mL | NaOH标准溶液的体积/mL | |
滴定前 | 滴定后 | ||
第一次 | 20.00 | 0.00 | 20.48 |
第二次 | 20.00 | 0.22 | 20.20 |
第三次 | 20.00 | 0.36 | 20.38 |
则黄铁矿样品中硫元素的质量分数为___________。
(6)也有人提出用“沉淀质量法”测定黄铁矿中含硫质量分数,若用这种方法测定,最好是在装置①所得吸收液中加入下列哪种试剂__________ 。
A.硝酸银溶液 B.氯化钡溶液 C.澄清石灰水 D.酸性高锰酸钾溶液
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
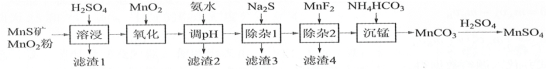
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。